آمونیوم کلرید یک ترکیب معدنی با فرمول شیمیایی (NH4Cl) و یک نمک جامد کریستال سفید رنگ و بدون بو است. این ماده در آب به خوبی حل می شود و محلول آن به دلیل خاصیت اسیدی ملایمی که دارد، برای تنظیم pH کاربردی است. آمونیوم کلرید را با نام های دیگری همچون کلرید آمونیوم، سال آمونیاک، سالمیاک، نمک آمونیوم کلراید، کلرامونیک، کلرور آمونیوم و نام تجاری نشادر نیز می شناسند.
این ماده به صورت طبیعی در اطراف آتشفشان ها یافت شده و کاربرد های متعددی در صنعت، پزشکی، صنایع غذایی، داروسازی و غیره دارد. این محصول در طی واکنش آمونیاک و هیدروکلریک اسید به دست می آید.
خرید آمونیوم کلرید
برای خرید آنلاین آمونیوم کلرید با بهترین قیمت و تضمین کیفیت از بهترین برندهای موجود بازار از فروشگاه معتبر ایآز بازدید نمائید
فهرست مطالب
تاریخچه آمونیوم کلرید

آمونیوم کلرید برای اولین بار در سال 554 پس از میلاد در چین کشف شد. منابع این ترکیب معدنی عبارت بودند از:
- منافذ آتش سوزی زیرزمینی زغال سنگ در آسیای مرکزی به ویژه کوه های تیان شان
- فومارول های آتشفشان کوه تفتان در جنوب شرقی ایران
در حدود 800 سال پس از میلاد، اعراب مصر کلرید آمونیوم را در دوده حاصل از سوزاندن سرگین شتر کشف کردند که این موجب شد تا منبع جایگزینی برای منابع آسیای مرکزی باشد.
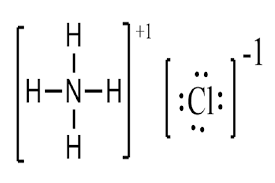
ساختار آمونیوم کلرید
ساختار آمونیوم کلرید از یک شبکه یونی تشکیل شده است که در آن کاتیونهای آمونیوم (NH۴+) با آنیونهای کلرید (Cl–) پیوند یونی تشکیل میدهند.
در این ساختار، کاتیونهای آمونیوم به صورت چهاروجهی منظم در اطراف یکدیگر قرار میگیرند و آنیونهای کلرید در فضای بین آنها قرار میگیرند.
این ساختار به آمونیوم کلرید یک ساختار بلوری میدهد.
در شکل زیر، ساختار آمونیوم کلرید نشان داده شده است:
روش تولید آمونیوم کلرید
آمونیوم کلرید (NH۴Cl) یک ترکیب شیمیایی با فرمول شیمیایی NH۴Cl است. این یک نمک سفید، بیبو و کریستالی است که در آب به خوبی حل میشود. آمونیوم کلرید یک ترکیب غیر آلی است که به طور طبیعی در برخی از آتشفشانها یافت میشود. این ماده همچنین میتواند به عنوان محصول جانبی احتراق زغال سنگ تولید شود.
آمونیوم کلرید به طور صنعتی از واکنش آمونیاک و اسید کلریدریک تولید میشود:
NH۳ + HCl → NH۴Cl
این واکنش در یک ظرف بسته انجام میشود تا از فرار گاز آمونیاک جلوگیری شود. محلول آمونیوم کلرید حاصل سپس تبخیر میشود تا محصول جامد را به دست آورد.

روشهای دیگر تولید آمونیوم کلرید
علاوه بر روش تولید ذکر شده در بالا، روشهای دیگری نیز برای تولید آمونیوم کلرید وجود دارد، از جمله:
- واکنش سولفات آمونیوم با کلرید سدیم:
(NH۴)۲SO۴ + NaCl → 2NH۴Cl + Na۲SO۴
- واکنش اکسید آمونیوم با کلرید هیدروژن:
NH۴O + HCl → NH۴Cl + H۲O
- واکنش هیدروکسید آمونیوم با کلرید هیدروژن:
NH۴OH + HCl → NH۴Cl + H۲Oمشخصات فیزیکی و شیمیایی آمونیوم کلرید

| ویژگی | مقدار |
|---|---|
| فرمول شیمیایی | NH۴Cl |
| وزن مولکولی | ۵۳٫۴۹ گرم بر مول |
| نقطه ذوب | ۳۳۸ درجه سانتیگراد |
| نقطه جوش | ۵۳۲ درجه سانتیگراد |
| چگالی | ۱٫۵۳ گرم بر سانتیمتر مکعب |
| حلالیت در آب | ۷۷۰ گرم بر ۱۰۰ میلیلیتر در دمای ۲۵ درجه سانتیگراد |
| حلالیت در سایر حلالها | کمی در اتانول و اتر حل میشود |
| pH | ۶٫۶ |
| رسانایی الکتریکی | رسانا |
| رنگ | سفید |
| بو | بیبو |
| شکل | کریستالی |
کاربردهای آمونیوم کلرید
آمونیوم کلرید کاربردهای گستردهای دارد، از جمله:
کشاورزی: آمونیوم کلرید به عنوان یک کود شیمیایی برای تامین نیتروژن و کلرید برای گیاهان استفاده میشود.

ذکر این نکته حائز اهمیت است که به دلیل خاصیت اسیدی آمونیوم کلرید، استفاده از آن به عنوان کود فقط برای خاک هایی که شور یا قلیایی هستند مجاز بوده و فراموش کردن این نکته و استفاده نامناسب از آن می تواند به خاک آسیب رسانده، موجب اسیدی شدن آن و از بین رفتن محصولات زراعی شود.
- داروسازی: آمونیوم کلرید به عنوان یک دیورتیک برای افزایش تولید ادرار استفاده میشود. همچنین به عنوان یک خلط آور برای کمک به شل شدن مخاط در ریهها استفاده میشود.

- صنعت: آمونیوم کلرید در تولید پلاستیک، مواد منفجره و سایر مواد شیمیایی استفاده میشود.

سایر کاربردهای آمونیوم کلرید در صنایع مختلف:
- قابل استفاده در شامپو و محصولات مراقبتی از مو سر
- قابل استفاده در ساخت انواع وسایل آتشبازی و محترقه
- در صنعت چرمسازی و دباغی از این ترکیب استفاده فراوانی میشود
- قابل استفاده در صنعت پارچه و رنگرزی
- قابل استفاده در صنعت نساجی و نجاری
- قابل استفاده در تهیه گدازه و فلزات مختلف
7 نکته برای ایمنی آمونیوم کلرید

- در صورت تماس آمونیوم کلرید با پوست و چشم ها ممکن است موجب سوزش شدید شود، سریعا محل آلوده شده را حداقل به مدت 15 دقیقه با آب فراوان بشویید.
- در صورتی که کلرید آمونیوم به اشتباه خورده شد بلافاصله آب فراوان بنوشید و خود را وادار به استفراغ نکنید و نهایتا به پزشک مراجعه کنید.
- در صورت استنشاق ممکن است موجب سرفه و تنگی نفس بشود، در این صورت هر چه سریعتر به محیط آزاد بروید و نفس بکشید.
- به منظور جلوگیری از هر گونه خطرات احتمالی هنگام کار با كلريد آمونیوم حتما از تجهیزات ایمنی نظیر دستکش، عینک و روپوش آزمایشگاه استفاده کنید.
- در صورت بروز هر یک از اتفاقات ذکر شده فورا به پزشک اورژانس مراجعه کنید.
- همچنین هنگام استفاده از گرید خوراکی آمونیوم کلرید، بیماران باید از نظر علائم سمیت با آمونیاک نظیر آریتمی قلبی، تنفس نامنظم، تعریق، رنگ پریدگی و غیره تحت نظر باشند.
- مصرف نمک آمونیوم کلرید در بیمارانی که دچار نارسایی کبدی و کلیوی هستند ممنوع می باشد.
بستهبندی و نگهداری صحیح آمونیوم کلرید
آمونیوم کلرید معمولاً در کیسههای پلیاتیلنی یا جعبههای مقوایی بستهبندی میشود. کیسههای پلیاتیلنی معمولاً برای بستهبندی مقادیر کم آمونیوم کلرید استفاده میشوند. جعبههای مقوایی معمولاً برای بستهبندی مقادیر زیاد آمونیوم کلرید استفاده میشوند.
آمونیوم کلرید باید در مکانی خشک و خنک و دور از دسترس کودکان و حیوانات خانگی نگهداری شود. دمای مناسب برای نگهداری آمونیوم کلرید بین 10 تا 25 درجه سانتیگراد است.
آمونیوم کلرید باید در معرض نور مستقیم خورشید یا گرما قرار نگیرد. قرار گرفتن آمونیوم کلرید در معرض نور مستقیم خورشید یا گرما میتواند باعث تجزیه آن و آزاد شدن گاز آمونیاک شود. گاز آمونیاک یک گاز سمی است که میتواند باعث تحریک چشم، بینی و گلو شود.




بازار جهانی آمونیوم کلرید
بازار جهانی آمونیوم کلرید در سال 2022 ارزشی معادل 12.6 میلیارد دلار داشت و پیشبینی میشود که تا سال 2028 به 15.8 میلیارد دلار برسد. این رشد به دلیل افزایش تقاضا برای آمونیوم کلرید در بخشهای کشاورزی، داروسازی و صنعت است.
چین، هند، ایالات متحده و روسیه بزرگترین تولیدکنندگان آمونیوم کلرید در جهان هستند.
چین، ایالات متحده، هند و اتحادیه اروپا بزرگترین مصرفکنندگان آمونیوم کلرید در جهان هستند.