سدیم سولفات(Na2SO4) با نامهای سولفات سدیم، نمک گلوبر و سولفات سودا نیز شناخته میشود و یک نمک معدنی از اسید سولفوریک است.
این ترکیب از نظر ساختار مولکولی به صورت هیدراته و بدون آب تولید میشود. تمام فرمهای ساختاری سدیم سولفات، جامد سفید رنگ هستند و در آب حل میشوند.
فرم دکا هیدراته این نمک یا همان سولفات ده آبه، سالانه ۶ میلیون تن تولید میشود و یک محصول شیمیایی عمده است. این ماده عمدتاً برای ساخت مواد شوینده و فرآیند کرافت در تهیه خمیر کاغذ استفاده میشود.
خرید سدیم سولفات
برای خرید آنلاین سدیم سولفات با بهترین قیمت و تضمین کیفیت از بهترین برندهای موجود بازار از فروشگاه معتبر ایآز بازدید نمائید
فهرست مطالب
تاریخچه کشف سدیم سولفات
تاریخچه کشف سدیم سولفات به قرن شانزدهم میلادی برمی گردد. در آن زمان، مردم از آب دریا برای تولید نمک استفاده می کردند. در فرآیند تبخیر آب دریا، سدیم سولفات به عنوان یک محصول جانبی تولید می شد.
در سال 1625، یک شیمیدان آلمانی به نام یوهان رودولف گلاوبر موفق به تولید سدیم سولفات خالص شد.او این ماده را نمک گلابر نامید.
در قرن نوزدهم، با توسعه فرآیند Leblanc، تولید سدیم سولفات به طور قابل توجهی افزایش یافت.

ساختار سدیم سولفات
سدیم سولفات یک ترکیب یونی است که از دو یون سدیم مثبت (Na+) و یک یون سولفات منفی (SO42-) تشکیل شده است. ساختار یونی سدیم سولفات به شرح زیر است:
Na+
-O-
S=O
-O-
Na+
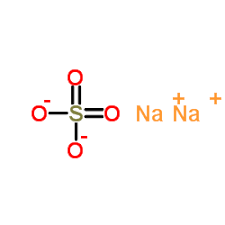
در این ساختار، یون های سدیم با طریق پیوند یونی به یون سولفات متصل شده اند. یون سولفات از چهار اتم اکسیژن و یک اتم گوگرد تشکیل شده است. اتم گوگرد در مرکز یون قرار دارد و اتم های اکسیژن در اطراف آن قرار گرفته اند. هر اتم اکسیژن با اتم گوگرد با یک پیوند دوگانه متصل شده است.
سولفات سدیم در طبیعت به سه حالت مختلف یافت می شود. سولفات سدیم بدون آب به عنوان ماده ای معدنی و کمیاب به نام تناردیت شناخته می شود و به عنوان عامل خشک کننده در سنتز مواد آلی استفاده می شود. هپتاهیدرات گونه ای دیگر از سولفات سدیم می باشد که بسیار نادر است. سولفات سدیم دکا هیدرات معروف به کانی میرابیلیت که به طور گسترده ای توسط صنایع شیمیایی مورد استفاده قرار می گیرد. همچنین به عنوان نمک گلوبر شناخته می شود.
منابع معدنی سدیم سولفات
سدیم سولفات به طور طبیعی در بسیاری از منابع معدنی یافت می شود، از جمله:
- #1معادن نمک: سدیم سولفات یک عنصر رایج در معادن نمک است. این ماده معمولاً به عنوان یک محصول جانبی در فرآیند استخراج نمک تولید می شود.
- #2گچ و سنگ گچ: گچ و سنگ گچ حاوی مقادیر زیادی سولفات سدیم هستند. این مواد معمولاً برای تولید گچ و سایر محصولات ساختمانی استفاده می شوند.
- #3سولفات های معدنی: سولفات سدیم همچنین در برخی از سولفات های معدنی مانند میرابیلیت و هالنیت یافت می شود. این مواد معمولاً به عنوان مواد اولیه برای تولید سدیم سولفات استفاده می شوند.
**سدیم سولفات یک ماده فراوان و ارزان است. این ماده معمولاً به عنوان یک محصول جانبی در فرآیندهای صنعتی تولید می شود یا از معادن نمک استخراج می شود.

مشخصات فیزیکی و شیمیایی سدیم سولفات
| ویژگی | مقدار |
|---|---|
| فرمول شیمیایی | Na2SO4 |
| جرم مولکولی | 142.04 گرم بر مول |
| نقطه ذوب | 884 درجه سانتیگراد |
| نقطه جوش | 1422 درجه سانتیگراد |
| چگالی | 2.66 گرم بر سانتی متر مکعب |
| حلالیت در آب | 40 گرم در 100 میلی لیتر آب در 20 درجه سانتیگراد |
| حلالیت در سایر حلال ها | حلال در الکل، گلیسرول و اتر |
| رنگ | سفید |
| بو | بدون بو |
| pH | 7 |
| رسانایی الکتریکی | رسانا |
| انحلال پذیری در هوا | کمی انحلال پذیر |
| واکنش پذیری | نسبتاً غیر واکنش پذیر |
| سمیت | غیر سمی |

تولید صنعتی سدیم سولفات
در قرن نوزدهم، با توسعه فرآیند Leblanc، تولید سدیم سولفات به طور قابل توجهی افزایش یافت. در این فرآیند، سولفات سدیم از واکنش کلرید سدیم و گوگرد تولید می شد.
فرآیند Leblanc یک فرآیند شیمیایی پیچیده بود که شامل چندین مرحله بود. در مرحله اول، کلرید سدیم با اسید سولفوریک واکنش داده و تولید کلرید هیدروژن سولفات و سدیم سولفات می کرد. در مرحله دوم، کلرید هیدروژن سولفات با آهک واکنش داده و تولید سولفات سدیم و کلر می کرد. در مرحله سوم، کلر با آب واکنش داده و تولید اسید کلریدریک می کرد.
فرآیند Leblanc یک فرآیند بسیار آلاینده بود و تولید مقادیر زیادی گازهای سمی مانند دی اکسید گوگرد و کلرید هیدروژن می کرد. این امر باعث شد که دولت ها در بسیاری از کشورها از استفاده از این فرآیند جلوگیری کنند.

**سدیم سولفات همچنین می تواند به عنوان یک محصول جانبی در برخی از فرآیندهای صنعتی تولید شود، مانند:
- تولید اسید سولفوریک: در فرآیند تولید اسید سولفوریک، دی اکسید گوگرد با آب واکنش داده و تولید اسید سولفوریک و سولفات سدیم می کند.
- تولید کاغذ: در فرآیند تولید کاغذ، سدیم سولفات به عنوان عامل رنگ زدایی و ضد عفونی کننده استفاده می شود.
فرآیند های مدرن تولید سدیم سولفات
امروزه، فرآیند های مدرن تولید سدیم سولفات جایگزین فرآیند Leblanc شده اند. این فرآیند ها آلاینده کمتری تولید می کنند و کارآمدتر هستند.
یکی از رایج ترین فرآیند های مدرن تولید سدیم سولفات، فرآیند Solvay است. در این فرآیند، کربن دی اکسید با آمونیوم سولفات واکنش داده و تولید سدیم سولفات و آمونیاک می کند. آمونیاک سپس با اسید سولفوریک واکنش داده و تولید اسید هیدروکلریک و سولفات سدیم می کند.
فرآیند دیگری که برای تولید سدیم سولفات استفاده می شود، فرآیند Mannheim است. در این فرآیند، دی اکسید گوگرد با هیدروکسید سدیم واکنش داده و تولید سدیم سولفات و آب می کند.
کاربردهای سدیم سولفات
سدیم سولفات یکی از پرمصرف ترین مواد شیمیایی در جهان است. این ماده در صنایع مختلف کاربرد دارد.
برخی از کاربردهای سدیم سولفات عبارتند از:
- صنعت کاغذ:این ماده در فرآیند تولید کاغذ به عنوان عامل رنگ زدایی و ضد عفونی کننده استفاده می شود.
- صنعت نساجی: سدیم سولفات در فرآیند تولید پارچه برای تثبیت رنگ و ضدعفونی کردن استفاده می شود.
- صنعت تصفیه آب: همچنین سدیم سولفات برای حذف رسوبات و مواد معدنی از آب استفاده می شود.
- صنعت کشاورزی: سدیم سولفات به عنوان کود و اصلاح کننده خاک استفاده می شود.
- صنعت تولید مواد غذایی: سدیم سولفات به عنوان نگهدارنده و عامل غلظت دهنده در غذا استفاده می شود.
- همچنین سولفات سدیم به عنوان پیش ماده سنتز ترکیباتی مانند سولفات سرب، سولفات پتاسیم، سولفات آلومینیوم و … استفاده می شود.
خطرات و موارد ایمنی سدیم سولفات
سولفات سدیم یک ماده غیر سمی و غیر قابل اشتعال است، اما در صورت بلعیدن مقادیر زیاد می تواند باعث ناراحتی معده شود. همچنین می تواند باعث تحریک پوست و چشم شود.
در صورت تماس با سولفات سدیم، باید فوراً پوست یا چشم را با آب فراوان شستشو داد. اگر سولفات سدیم بلعیده شد، باید فوراً به پزشک مراجعه کرد.
برای کاهش خطرات احتمالی سولفات سدیم، باید اقدامات ایمنی زیر را رعایت کرد:
- هنگام کار با سولفات سدیم، از عینک ایمنی، دستکش و لباس محافظ استفاده کنید.
- سولفات سدیم را در مکانی خشک و خنک و به دور از دسترس کودکان و حیوانات خانگی نگهداری کنید.
نگهداری و بسته بندی سدیم سولفات







سولفات سدیم باید در مکانی خشک و خنک و به دور از نور مستقیم خورشید نگهداری شود. این ماده در برابر رطوبت و هوا مقاوم است، اما باید از تماس با مواد اکسید کننده و اسیدها جلوگیری شود.
سولفات سدیم معمولاً در کیسه های پلاستیکی یا کیسه های کاغذی بسته بندی می شود. این ماده همچنین می تواند در بشکه ها یا تانک های فلزی بسته بندی شود.
در هنگام حمل و نقل سولفات سدیم، باید از بسته بندی محکم استفاده شود تا از آسیب دیدن ماده جلوگیری شود. همچنین باید از تماس سولفات سدیم با سایر مواد شیمیایی جلوگیری شود.
بازار جهانی سدیم سولفات

بازار جهانی سدیم سولفات یک بازار بزرگ و پویا است. این بازار به طور مداوم در حال رشد است و انتظار می رود که این روند در سال های آینده نیز ادامه یابد.
تقاضا برای سدیم سولفات از صنایع مختلف، از جمله صنعت کاغذ، صنعت نساجی، صنعت تصفیه آب، صنعت کشاورزی و صنعت تولید مواد غذایی، ناشی می شود.
بر اساس گزارش شرکت تحقیقاتی Global Market Insights، بازار جهانی سدیم سولفات در سال 2022 ارزشی بالغ بر 20 میلیارد دلار داشت. این بازار انتظار می رود که با نرخ رشد ترکیبی سالانه (CAGR) 4.5 درصد از سال 2023 تا 2028 به 28 میلیارد دلار برسد.
آمریکا، چین و هند بزرگترین بازارهای سدیم سولفات در جهان هستند. این سه کشور به طور مشترک بیش از 50 درصد از تقاضای جهانی را به خود اختصاص می دهند.
در آینده، انتظار می رود که بازارهای در حال توسعه مانند هند، چین و برزیل به رشد سریع بازار سدیم سولفات ادامه دهند.








































در ارتباط باشید