سولفات روی یک ماده معدنی با فرمول ZnSO4 است. این یک ماده جامد سفید یا بی رنگ است که در آب بسیار محلول است. سولفات روی در طبیعت به عنوان ماده معدنی هکتوهیدرات ، هگزاهیدرات و ان-هیدرات یافت می شود.
زینک سولفات یک مکمل غذایی است. در طول تاریخ به آن ویتوریول سفید گفته می شد. همچنین به عنوان Zincate ، Zinc sulfate شناخته می شود.
این ترکیب در فهرست داروهای ضروری سازمان بهداشت جهانی ذکر شده است. شما باید از مصرف این دارو با غذاهایی که دارای فسفر یا کلسیم زیادی هستند خودداری کنید زیرا این امر جذب بدن را برای شما دشوار می کند.
ابن ماده غیر قابل احتراق است و در آب محلول است. در هنگام تجزیه ، گازهای سمی اکسید روی و اکسیدهای گوگرد منتشر می شود. به طور گسترده ای در پیشگیری و درمان کمبود روی استفاده می شود.
خرید سولفات روی
برای خرید آنلاین سولفات روی با بهترین قیمت و تضمین کیفیت از بهترین برندهای موجود بازار از فروشگاه معتبر ایآز بازدید نمائید
فهرست مطالب
نگاهی به تاریخچه سولفات روی

تاریخچه سولفات روی به قرن ها پیش برمی گردد. در زمان های قدیم، از سنگ معدن روی برای ساخت برنج استفاده می شد. ترکیبات روی نیز برای التیام زخمها و چشم درد استفاده می شد.
در قرن سیزدهم، مارکوپولو تولید اکسید روی در ایران و چگونگی تهیه توتیا (محلول سولفات روی) توسط ایرانیان،برای درمان دردهای چشم را شرح داد.
در قرن هفدهم، یوهان رودولف گلاوبر، یک شیمیدان آلمانی، سولفات روی را از آب چشمه اتریش کشف کرد که شکل هیدرات آن را نمک گلابر یا همان نمک معجزه آسا نامید.
در قرن نوزدهم، فرآیند Leblanc برای تولید سودا و یکی از فرآیندهای شیمیایی عمده در جهان، سولفات روی را به روش اصلی تولید سودا تبدیل کرد.
کاربردهای سولفات روی در طول تاریخ به تدریج توسعه یافته است. در قرن بیستم، سولفات روی به عنوان یک مکمل غذایی، کود و ماده شیمیایی صنعتی مورد استفاده قرار گرفت.
شکل های مختلف سولفات روی
سولفات روی به صورت های مختلفی وجود دارد که رایج ترین آنها عبارتند از:
- هپتاهیدرات (ZnSO4·7H2O): این شکل رایج ترین شکل سولفات روی است. در این شکل، یون روی توسط هفت مولکول آب احاطه شده است.
- ان-هیدرات (ZnSO4): این شکل در دمای بالا پایدار است. در این شکل، یون روی توسط هیچ مولکول آبی احاطه نشده است.
سولفات روی، یک ماده مغذی مهم برای حیات انسان، جانداران و گیاهان است و کمبود این ماده، ادامه حیات را تحت تاثیر قرار میدهد و عوارض منفی در پی دارد.
ساختار سولفات روی
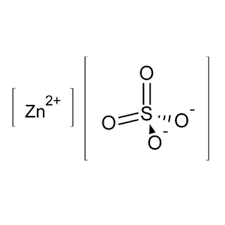
ساختار سولفات روی یک ساختار یونی است که از یون های روی و سولفات تشکیل شده است. یون روی یک یون دو ظرفیتی است که با علامت Zn2+ نشان داده می شود. یون سولفات یک یون چهار ظرفیتی است که با علامت SO42- نشان داده می شود.
روشهای تولید سولفات روی
روشهای تولید سولفات روی به دو دسته کلی تقسیم میشوند:
- روشهای مستقیم
- روشهای غیرمستقیم
روشهای مستقیم
در روشهای مستقیم، روی به طور مستقیم با اسید سولفوریک واکنش داده و سولفات روی تولید میشود. این روشها معمولاً برای تولید مقادیر کم سولفات روی استفاده میشوند.
واکنش کلی:
Zn + H2SO4 → ZnSO4 + H2
روشهای غیرمستقیم
در روشهای غیرمستقیم، ابتدا یک ترکیب روی با اسید سولفوریک واکنش داده و یک ترکیب میانی تولید میشود. سپس این ترکیب میانی با یک عامل شیمیایی دیگر واکنش داده و سولفات روی تولید میشود.
روشهای غیرمستقیم رایج عبارتند از:
- –روش اکسید روی و اسید سولفوریک
در این روش، اکسید روی با اسید سولفوریک واکنش داده و سولفات روی تولید میشود.
واکنش کلی:
ZnO + H2SO4 → ZnSO4 + H2O
- –روش سنگ معدن روی و اسید سولفوریک
در این روش، سنگ معدن روی با اسید سولفوریک واکنش داده و سولفات روی تولید میشود.
واکنش کلی:
ZnS + H2SO4 → ZnSO4 + H2S
- –روش کلرید روی و اسید سولفوریک
در این روش، کلرید روی با اسید سولفوریک واکنش داده و سولفات روی تولید میشود.
واکنش کلی:
ZnCl2 + H2SO4 → ZnSO4 + 2HCl
.

روشهای تولید سولفات روی در صنعت
در صنعت، روش اکسید روی و اسید سولفوریک برای تولید سولفات روی استفاده میشود. در این روش، اکسید روی با اسید سولفوریک غلیظ واکنش داده و سولفات روی تولید میشود.
واکنش کلی:
ZnO + H2SO4 → ZnSO4 + H2O
در این واکنش، اکسید روی به عنوان یک کاتالیزور عمل میکند و باعث افزایش سرعت واکنش میشود.
فرآیند تولید سولفات روی به روش اکسید روی و اسید سولفوریک به شرح زیر است:
- ابتدا اکسید روی در یک ظرف واکنش قرار میگیرد.
- سپس اسید سولفوریک غلیظ به تدریج به ظرف واکنش اضافه میشود.
- واکنش بین اکسید روی و اسید سولفوریک انجام میشود و سولفات روی تولید میشود.
- سولفات روی تولید شده از محلول واکنش جداسازی میشود.
سولفات روی تولید شده در این روش به شکل هپتاهیدرات است.
مشخصات فیزیکی و شیمیایی سولفات روی

| مشخصه | مقدار |
|---|---|
| فرمول شیمیایی | ZnSO4 |
| جرم مولکولی | 161.47 g/mol |
| چگالی | 3.54 g/cm3 |
| نقطه ذوب | 680 درجه سانتیگراد |
| نقطه جوش | 1200 درجه سانتیگراد |
| انحلال پذیری در آب | 22 گرم در 100 میلی لیتر آب در دمای 20 درجه سانتیگراد |
| حلالیت در الکل | 1.4 گرم در 100 میلی لیتر الکل در دمای 20 درجه سانتیگراد |
| pH محلول آبی | 4.74 |
| رنگ | سفید یا بی رنگ |
| شکل ظاهری | جامد بلوری |
| هدایت الکتریکی | 1.2 S/m |
| رسانایی گرمایی | 2.02 W/m·K |
| ضرایب شکست | 1.618 |
| ضریب انبساط حرارتی | 1.6 × 10^-5 K^-1 |
| سختی برکول | 4.5 |
| انرژی شبکه | 242 kJ/mol |
| انرژی آزاد تشکیل | -192 kJ/mol |
4 کاربرد کلی سولفات روی
سولفات روی کاربردهای گسترده ای در صنایع مختلف دارد. برخی از کاربردهای مهم سولفات روی عبارتند از:
- 1.کود: سولفات روی به عنوان یک منبع روی برای گیاهان استفاده می شود. روی یک ماده مغذی ضروری برای گیاهان است که در رشد و توسعه آنها نقش دارد.

- 2.مواد شیمیایی: سولفات روی در تولید سایر مواد شیمیایی، مانند کلرید روی، سولفید روی و اکسید روی استفاده می شود.



- 3.مکمل غذایی: سولفات روی به عنوان یک مکمل غذایی برای تامین روی بدن استفاده می شود. روی یک ماده معدنی ضروری برای بدن است که در عملکرد بسیاری از سیستم های بدن نقش دارد.

- 4.صنایع دیگر: سولفات روی در صنایع مختلف، مانند صنایع کاغذ، صنایع رنگ و صنایع لاستیک استفاده می شود.
علائم کمبود روی در گیاهان مختلف
رنگ سبز یا زرد در برگهای جوان، یا لکه های سوخته در محلهای میان رگبرگها در برگهای نسبتاً مسن، برگهای جوان در انتهای شاخه که بصورت زرد در می آیند، کوچک ماندن گیاه، خشکیدگی بعضی از بافتها، تأخیر در رسیدگی و بلوغ و رشد نامناسب میوه ها.

خسارت مهم کمبود روی ریختن میوه های درختان دانه دار و هسته دار در طول تکامل آنهاست و شدیدترین حالت را میتوان در هنگامی که سیب به اندازه گردو میشود مشاهده نمود. در این شرایط گاهاً تا 80 درصد میوه درختان ریزش خواهد داشت. در مرکبات کمبود روی با پوست کلفت شدن و ضخیم شدن سفیده و غیر قابل فروش شدن میوه نمایان میگردد.
سولفات روی برای مو و پوست
مصرف سولفات روی می تواند سبب بهبود مشکلات پوستی، آکنه، پسوریازیس و… شود، همچنین با اینکه افزایش رشد مو با مصرف آن به اثبات نرسیده است ،اما استفاده از آن می تواند در کاهش ریزش و افزایش استحکام ساقه و ریشه ی مو موثر باشد.

خطرات سولفات روی
سولفات روی در صورت بلع زیاد می تواند باعث مسمومیت شود. علائم مسمومیت با سولفات روی شامل حالت تهوع، استفراغ، اسهال و درد شکمی است. سولفات روی می تواند باعث تحریک پوست و چشم شود.

دوز ایمن سولفات روی برای بزرگسالان به طور کلی 25 تا 50 میلی گرم در روز است. دوز ایمن سولفات روی برای کودکان زیر 12 سال 15 میلی گرم در روز است.
شرایط نگهداری و بستهبندی سولفات روی
کیسههای مخصوص نگهداری زینک سولفات باید در انبارهای خشک و خنک و دور از هر رطوبت نگهداری شوند. حتماً از تماس با پوست، چشم و لباس اجتناب شود. باید هنگام کار کردن با این ماده در صنعت از خوردن و استنشاق خودداری کنید.
کیسهها و مخازن مخصوص نگهداری سولفات روی باید در ظرف محکم و درب بسته نگهداری شود. انبارهای این مواد باید به دور از هر مواد ناسازگار و در محلی خنک و با تهویه مناسب نگهداری شود.
بسته بندیهای حاوی سولفات روی به صورت کریستالی و پودری در وزنهای ۱۰ کیلوگرم، ۲۵ کیلوگرم و ۵۰ کیلوگرم در بازار وجود دارد. این ترکیب در حالت کریستالی با درصد خلوص ۱۸ تا ۲۰ درصد و یا ۲۴ درصد به فروش میرسد. فروش زینک سولفات پودری عموماً درصد خلوص ۳۲% یا ۲۲% انجام میگیرد.





وضعیت بازار سولفات روی
در کشورهای قاره آمریکای جنوبی و همچنین کشورهای کمتر توسعه یافته آسیایی به دلیل وقوع مشکلات سلامتی نشات گرفته از کمبود Zn، درخواست برای خرید سولفات روی جهت استفاده در صنایع پزشکی رو به افزایش است. همچنین بهبود میزان صادرات محصولات کشاورزی با افزایش راندمان تولید در کشورهای توسعه یافته سبب اوج گرفتن تقاضا برای خرید این محصول توسط صنایع تولید کننده کودهای شیمیایی گردیده است که از تاثیر آن بر بازار فروش این ماده شیمیایی نمیتوان چشم پوشی کرد.
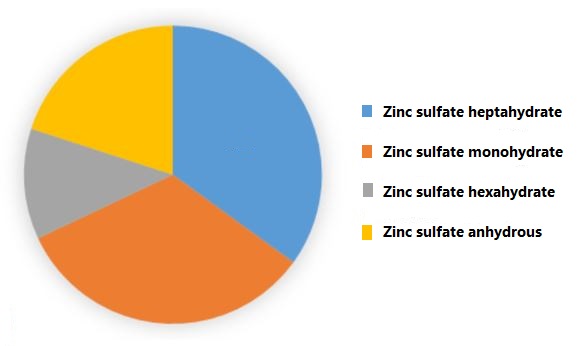
مطابق شکل زیر بیشترین بازار این محصول به ترتیب به انواع هپتا، مونو، بدون آب و هگزا هیدرات تعلق دارد.


در ارتباط باشید