آمونیوم سولفات یکی از نمک های معدنی و غیرآلی است که در صنایع مختلف به خصوص کشاورزی، بسیار مورد استفاده قرار می گیرد.همان طور که از فرمول آن مشخص است، برای تامین گوگرد و ازت درختان و محصولات زراعی به کاربرده می شود.
خرید آمونیوم سولفات
برای خرید آنلاین آمونیوم سولفات با بهترین قیمت و تضمین کیفیت از بهترین برندهای موجود بازار از فروشگاه معتبر ایآز بازدید نمائید.
فهرست مطالب
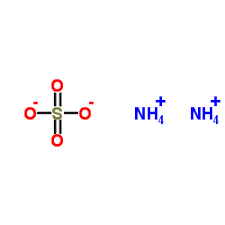
ترکیب شیمیایی سولفات آمونیوم بانامهای نمک دی آمونیوم اسیدسولفوریک یا سولفات دی آمونیوم نیز شناخته میشود. فرمول شیمیایی آن (NH4)2 SO4 است. این ترکیب یکی از پرکاربردترین و اولین کودهای نیتروژنی برای محصولات کشاورزی بود.
نگاهی به تاریخچه آمونیوم سولفات
آمونیوم سولفات به طور طبیعی به صورت یک کانی معدنی با نام ماسکاگنیت (Mascagnite) در بخارات آتشفشانی و در اثر آتش سوزی ذغال در بقایای آن تشکیل میشود.
ماسکاگنیت یک کانی کمیاب است که به صورت بلورهای کوچک و بیرنگ یا سفید یافت میشود. این کانی در دمای بالا و در حضور آمونیاک و سولفور دیاکسید تشکیل میشود.
ماسکاگنیت در بخارات آتشفشانی در مناطقی که فعالیت آتشفشانی وجود دارد یافت میشود. این کانی همچنین در بقایای آتش سوزی ذغال در مناطقی که ذخایر ذغال وجود دارد یافت میشود.

مشخصات فیزیکی و شیمیایی آمونیوم سولفات
| ویژگی | مقدار |
|---|---|
| فرمول شیمیایی | (NH₄)₂SO₄ |
| وزن مولکولی | 132.14 گرم بر مول |
| نقطه ذوب | 235 درجه سانتیگراد |
| نقطه جوش | 338 درجه سانتیگراد |
| چگالی | 1.77 گرم بر سانتی متر مکعب |
| حلالیت در آب | 91 گرم بر 100 میلی لیتر آب در 20 درجه سانتیگراد |
| PH | 5.5 |
| انحلال پذیری در سایر حلال ها | نامحلول در اتر، کلروفرم و بنزن |
| خواص فیزیکی | جامد بلوری سفید یا بی رنگ |
| بو | بی بو |
| طعم | شور |
| خواص شیمیایی | اسیدی |
تولید آمونیوم سولفات
آمونیوم سولفات را میتوان به دو روش تولید کرد:
روش تجزیه حرارتی
در این روش، آمونیاک و اسید سولفوریک را در یک واکنش حرارتی با هم ترکیب میکنند. این واکنش به صورت زیر انجام میشود:
2NH₃ + H₂SO₄ → (NH₄)₂SO₄
برای انجام این واکنش، ابتدا آمونیاک و اسید سولفوریک را در یک واکنشدهنده مخصوص ترکیب میکنند. سپس، واکنشدهنده را در دمای 200 تا 250 درجه سانتیگراد قرار میدهند. در این دما، واکنش انجام میشود و آمونیوم سولفات تولید میشود.

روش آمونیاکاسیون سولفوریک اسید
در این روش، سولفوریک اسید را با گاز آمونیاک مخلوط میکنند. این واکنش به صورت زیر انجام میشود:
H₂SO₄ + NH₃ → (NH₄)₂SO₄
برای انجام این واکنش، ابتدا سولفوریک اسید و گاز آمونیاک را در یک واکنشدهنده مخصوص مخلوط میکنند. سپس، واکنشدهنده را در دمای 20 تا 30 درجه سانتیگراد قرار میدهند. در این دما، واکنش انجام میشود و آمونیوم سولفات تولید میشود.
روش تجزیه حرارتی روش متداولتر تولید آمونیوم سولفات است. این روش نسبتاً ساده و مقرونبهصرفه است.
ساختار آمونیوم سولفات
فرمول شیمیایی آمونیوم سولفات (NH₄)₂SO₄ است که نشان می دهد این ماده از دو یون آمونیوم (NH₄⁺) و یک یون سولفات (SO₄²⁻) تشکیل شده است.
در ساختار آمونیوم سولفات، یون های آمونیوم به عنوان کاتیون ها و یون های سولفات به عنوان آنیون ها وجود دارند. یون های آمونیوم توسط یک اتم نیتروژن و چهار اتم هیدروژن تشکیل شده اند. یون های سولفات توسط یک اتم گوگرد و چهار اتم اکسیژن تشکیل شده اند.
یون های آمونیوم و سولفات به صورت یونی با یکدیگر پیوند دارند. این پیوندها یونی هستند زیرا یون های آمونیوم دارای بار مثبت هستند و یون های سولفات دارای بار منفی هستند.
کاربردهای آمونیوم سولفات
آمونیوم سولفات دارای کاربردهای مختلفی است که از جمله مهمترین آنها میتوان به موارد زیر اشاره کرد:
- کود کشاورزی:آمونیوم سولفات یک کود شیمیایی است که حاوی دو عنصر ضروری برای رشد گیاهان، یعنی نیتروژن و سولفور است. نیتروژن برای تولید کلروفیل و سولفور برای تولید پروتئین مورد نیاز است.
آمونیوم سولفات یک کود شیمیایی بسیار پرمصرف است. این کود به طور گسترده در محصولات کشاورزی مختلف، از جمله غلات، حبوبات، میوهها و سبزیجات استفاده میشود.
- عامل خنثی کننده:آمونیوم سولفات به عنوان یک عامل خنثی کننده در صنایع مختلف، از جمله تولید کاغذ، رنگ و پارچه استفاده می شود. این ماده می تواند اسید و باز را خنثی کند.
آمونیوم سولفات در تولید کاغذ، رنگ و پارچه برای خنثی کردن اسید و باز استفاده می شود. این ماده همچنین در تولید مواد شیمیایی مختلف، از جمله مواد شوینده و مواد ضد عفونی کننده، به عنوان یک عامل خنثی کننده استفاده می شود.
- ماده نگهدارنده:آمونیوم سولفات به عنوان یک ماده نگهدارنده در مواد غذایی استفاده می شود. این ماده می تواند از رشد میکروارگانیسم ها در مواد غذایی جلوگیری کند.
آمونیوم سولفات در تولید مواد غذایی مختلف، از جمله گوشت، ماهی، لبنیات و کنسروها، به عنوان یک ماده نگهدارنده استفاده می شود. این ماده همچنین در تولید مواد آرایشی و بهداشتی برای جلوگیری از رشد میکروارگانیسم ها استفاده می شود.
- مواد منفجره:آمونیوم سولفات در تولید برخی از مواد منفجره، از جمله آمونیوم نیترات، استفاده می شود.
آمونیوم سولفات در تولید مواد منفجره برای ایجاد یک واکنش انفجاری استفاده می شود. این ماده همچنین در ساخت مواد آتشبازی و سایر مواد انفجاری استفاده می شود.
- سایر کاربردها:آمونیوم سولفات همچنین در کاربردهای دیگری، از جمله تولید رنگدانه ها، تولید کاغذ و تولید پلاستیک استفاده می شود.
آمونیوم سولفات در تولید رنگدانه ها برای ایجاد رنگ های مختلف استفاده می شود. این ماده همچنین در تولید کاغذ برای بهبود خواص کاغذ استفاده می شود. آمونیوم سولفات همچنین در تولید پلاستیک برای بهبود خواص پلاستیک استفاده می شود.
2 نحوه استفاده آمونیوم سولفات
آمونیوم سولفات را میتوان به صورت محلول در آب یا به صورت جامد استفاده کرد.
برای استفاده از آمونیوم سولفات به صورت محلول، باید آن را با آب مخلوط کنید تا محلول اشباع حاصل شود. محلول اشباع به این معناست که دیگر نمک آمونیوم سولفات در آب حل نمیشود. میزان مصرف آمونیوم سولفات برای تهیه محلول اشباع، بسته به نوع گیاه، نوع خاک و شرایط آب و هوایی متفاوت است. معمولاً توصیه میشود که برای تهیه محلول اشباع آمونیوم سولفات، 100 گرم از این ماده را در یک لیتر آب حل کنید.
برای استفاده از آمونیوم سولفات به صورت جامد، باید آن را به خاک اضافه کرده و با خاک مخلوط کنید. میزان مصرف آمونیوم سولفات به صورت جامد، نیز بسته به نوع گیاه، نوع خاک و شرایط آب و هوایی متفاوت است. معمولاً توصیه میشود که برای هر متر مربع از سطح خاک، 100 تا 200 گرم آمونیوم سولفات به خاک اضافه کنید.
بهترین زمان برای استفاده از آمونیوم سولفات، ابتدای فصل رشد گیاهان است. در این زمان، گیاهان به نیتروژن بیشتری نیاز دارند.
خطرات و عوارض آمونیوم سولفات

آمونیوم سولفات یک ماده شیمیایی نسبتاً ایمن است، اما در صورت بلع یا استنشاق می تواند باعث تحریک چشم، بینی و گلو شود. همچنین، این ماده می تواند باعث تحریک پوست شود.
برای جلوگیری از خطرات آمونیوم سولفات، باید موارد زیر را رعایت کنید:
- آمونیوم سولفات را در مکانی خشک و خنک نگهداری کنید.
- هنگام کار با آمونیوم سولفات، از تجهیزات ایمنی مناسب، مانند دستکش، عینک ایمنی و ماسک استفاده کنید.
- در صورت تماس آمونیوم سولفات با پوست یا چشم، بلافاصله ناحیه را با آب فراوان بشویید.
- در صورت بلع آمونیوم سولفات، بلافاصله با پزشک تماس بگیرید.
آمونیوم سولفات یک ماده شیمیایی سمی برای ماهی و سایر موجودات آبزی است. بنابراین، باید از ریختن آمونیوم سولفات در محیط زیست خودداری کنید.
آمونیوم سولفات یک ماده شیمیایی نسبتاً پایدار است. با این حال، در صورت تماس با گرما یا رطوبت، میتواند تجزیه شود و گاز آمونیاک آزاد کند. گاز آمونیاک یک گاز سمی است که میتواند باعث تحریک چشم، بینی و گلو شود.
بستهبندی و نگهداری آمونیوم سولفات




آمونیوم سولفات معمولاً در کیسههای 25 کیلوگرمی، 50 کیلوگرمی و 100 کیلوگرمی بستهبندی میشود. این ماده همچنین میتواند به صورت پودر یا گرانول عرضه شود.
آمونیوم سولفات را باید در مکانی خشک و خنک نگهداری کرد. این ماده باید دور از رطوبت و گرما نگهداری شود. در صورت نگهداری نامناسب، آمونیوم سولفات میتواند جذب رطوبت کرده و به صورت کریستالهای سخت درآید.