باریم سولفات ترکیبی غیر آلی از باریت و گوگرد با نام شیمیایی سولفات باریم (باریم سولفات) است که به طور گسترده به شکلی جامد و سفید رنگ در طبیعت وجود دارد که با فرآیندی پیوسته تولید میشود.
سولفات باریم یک فلز قلیایی و دو ظرفیتی است که کاملا غیر سمی است و برای استفاده پزشکی نیز بی خطر است و این ماده یکی از نامحلول ترین نمک های قلیایی است که در آب و دیگر حلالها به آسانی حل نمیشود و فقط اسید سولفوریک غلیظ آن را حل میکند.
خرید باریم سولفات
برای خرید آنلاین باریم سولفات با بهترین قیمت و تضمین کیفیت از بهترین برندهای موجود بازار از فروشگاه معتبر ایآز بازدید نمائید
فهرست مطالب
تاریخچه کشف باریم سولفات

در سال 1774، شیمیدان فرانسوی، پییر کوری (Pierre Curie)، این ماده را به عنوان یک ترکیب شیمیایی با فرمول BaSO4 شناسایی کرد. او نام این ترکیب را «باریم سولفات» (Barium sulfate) گذاشت.
در سال 1896، پزشکان آلمانی، یوهان بورکهارد (Johann Georg Bockenheimer) و جوزف فون فرانک (Josef von Frank), از باریم سولفات به عنوان یک ماده حاجب در اشعه ایکس استفاده کردند. این ماده به دلیل خاصیت جذب بالای اشعه ایکس، به خوبی میتواند اعضای بدن را در تصویر اشعه ایکس نمایان کند.
از آن زمان تاکنون، باریم سولفات به یکی از پرکاربردترین مواد شیمیایی در جهان تبدیل شده است
ساختار باریم سولفات
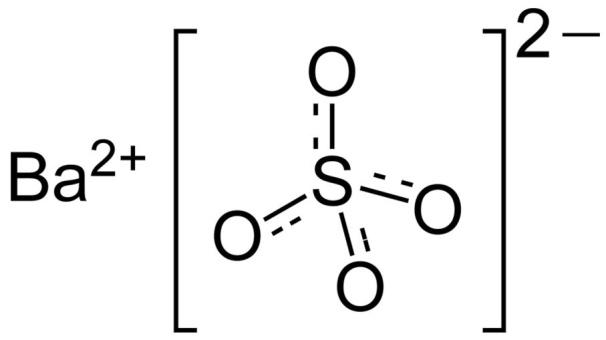
باریم سولفات (BaSO4) یک ترکیب یونی است که از ترکیب یونهای باریم (Ba2+) و یونهای سولفات (SO42-) تشکیل شده است. ساختار مولکولی باریم سولفات به صورت زیر است:
Ba2+
SO42-
در این ساختار، یونهای باریم به صورت کروی و یونهای سولفات به صورت شش ضلعی شکل قرار گرفتهاند. یونهای باریم با یونهای سولفات از طریق پیوند یونی به یکدیگر متصل شدهاند.
باریم سولفات یک ماده جامد سفید رنگ و بیبو است. این ماده در آب نامحلول است، اما در اسید سولفوریک غلیظ حل میشود.
چگونگی تولید باریم سولفات
باریم سولفات معمولاً از واکنش باریم کربنات با اسید سولفوریک تولید میشود. این واکنش به صورت زیر انجام میشود:
BaCO3 + H2SO4 → BaSO4 + CO2 + H2O
در این واکنش، باریم کربنات با اسید سولفوریک رقیق واکنش میدهد و باریم سولفات، دیاکسید کربن، و آب تولید میشود.
پس از انجام واکنش، باریم سولفات جامد حاصل را از مخلوط جدا میکنند و خشک میکنند. باریم سولفات تولید شده معمولاً دارای خلوص بالایی است.

روشهای دیگر تولید باریم سولفات
علاوه بر روش ذکر شده، روشهای دیگری نیز برای تولید باریم سولفات وجود دارد. از جمله این روشها میتوان به موارد زیر اشاره کرد:
- 1_واکنش باریم کلرید با سولفات سدیم:
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
- 2_واکنش باریم هیدروکسید با اسید سولفوریک:
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
- 3_واکنش باریم اکسید با اسید سولفوریک:
BaO + H2SO4 → BaSO4 + H2Oمشخصات فیزیکی و شیمیایی باریم سولفات
| ویژگی | مقدار |
|---|---|
| فرمول شیمیایی | BaSO4 |
| جرم مولی | 233.38 گرم بر مول |
| نقطه ذوب | 1580 درجه سانتیگراد |
| نقطه جوش | 1695 درجه سانتیگراد |
| حلالیت در آب | نامحلول |
| چگالی | 4.5 گرم بر سانتیمتر مکعب |
| رنگ | سفید |
| طعم | بیطعم |
| بو | بیبو |
| pH | 7 (خنثی) |
| رسانایی الکتریکی | نارسانا |
| رسانایی گرمایی | کم |
| ضریب شکست | 1.66 |
| سختی Mohs | 3.5 |

محلولیت و واکنش باریم سولفات در اسیدها و بازها
1**باریم سولفات در اسید سولفوریک غلیظ کاملاً حل میشود. این واکنش به صورت زیر است:
BaSO4 + H2SO4 → BaSO4(H2SO4)
در این واکنش، باریم سولفات با اسید سولفوریک واکنش میدهد و نمک باریم سولفات هگزاهیدرات (BaSO4(H2SO4)) را تولید میکند.
2**باریم سولفات در اسید نیتریک غلیظ نیز کاملاً حل میشود. این واکنش به صورت زیر است:
BaSO4 + 2HNO3 → Ba(NO3)2 + H2SO4
در این واکنش، باریم سولفات با اسید نیتریک واکنش میدهد و نمک باریم نیترات (Ba(NO3)2) و اسید سولفوریک را تولید میکند.
3**باریم سولفات در اسید هیدروکلریک غلیظ نیز کاملاً حل میشود. این واکنش به صورت زیر است:
BaSO4 + 2HCl → BaCl2 + H2SO4
در این واکنش، باریم سولفات با اسید هیدروکلریک واکنش میدهد و نمک باریم کلرید (BaCl2) و اسید سولفوریک را تولید میکند.
4**باریم سولفات در بازها نامحلول است. این واکنش به صورت زیر است:
BaSO4 + 2NaOH → Ba(OH)2 + Na2SO4
در این واکنش، باریم سولفات با سدیم هیدروکسید واکنش میدهد و نمک باریم هیدروکسید (Ba(OH)2) و سدیم سولفات (Na2SO4) را تولید میکند.
نتیجهگیری
باریم سولفات در اسیدهای قوی مانند اسید سولفوریک، نیتریک، و هیدروکلریک کاملاً حل میشود، اما در بازها نامحلول است.
کاربردهای باریم سولفات
باریم سولفات کاربردهای گستردهای در صنایع مختلف دارد.
1.ماده حاجب در اشعه ایکس:باریم سولفات یک ماده حاجب عالی در اشعه ایکس است. این ماده اشعه ایکس را به خوبی جذب میکند و باعث میشود که اعضای بدن با وضوح بیشتری در تصویر اشعه ایکس دیده شوند.
باریم سولفات در انواع مختلف آزمایشهای پزشکی، از جمله تصویربرداری اشعه ایکس، سونوگرافی، و سیتی اسکن استفاده میشود.
2.رنگدانه سفید:باریم سولفات یک رنگدانه سفید بسیار خالص است. این ماده در رنگهای روغنی، رنگهای پلاستیکی، و رنگهای دیوار استفاده میشود.
3.عامل ضدعفونی کننده:همچنین باریم سولفات یک ماده ضدعفونی کننده ضعیف است. این ماده در تصفیه آب و فاضلاب استفاده میشود.
4.عامل ضخیمکننده:باریم سولفات یک عامل ضخیمکننده موثر است. این ماده در سسها، سوپها، و سسهای مایونز استفاده میشود.باریم سولفات باعث میشود که این غذاها غلیظتر و قوامدارتر شوند.
5.تولید سرامیک،لاستیک، و کاغذ:باریم سولفات در تولید سرامیک، لاستیک، و کاغذ استفاده میشود. این ماده به بهبود خواص مکانیکی و شیمیایی این مواد کمک میکند.
سایر کاربردها
باریم سولفات در کاربردهای دیگری نیز استفاده میشود، از جمله:
- در تولید شیشه
- در تولید روغنهای معدنی
- در تولید دارو
- در تولید مواد منفجره
داروی باریم سولفات چیست؟
داروی باریم سولفات برای کمک به پزشکان در بررسی مری (لوله ای که دهان و معده را به هم متصل می کند) با استفاده از اشعه ایکس یا توموگرافی کامپیوتری استفاده می شود (سی تی اسکن (ct scan) نوعی اسکن بدن با اشعه ایکس برای ایجاد تصاویر مقطعی یا سه بعدی از داخل بدن به کمک کامپیوتر است).
سولفات باریم در گروهی از داروها قرار دارد که به آنها ماده حاجب رادیوپک می گویند. برای این عمل ابتدا دیواره مری ، معده یا روده را با ماده ای مانند سولفات باریم که جذب بدن نمی شود می پوشانند تا مناطق آسیب دیده در معاینه با اشعه ایکس یا سی تی اسکن به وضوح دیده شوند.
ذخیره و نگهداری باریم سولفات
باریم سولفات یک ماده شیمیایی غیرقابل اشتعال و غیرقابل انفجار است. این ماده در برابر اسیدها و بازها مقاوم است، اما در برابر رطوبت حساس است.
همچنین این ماده باید در مکانی خشک و خنک نگهداری شود. باریم سولفات باید در ظروف محکم و دربسته نگهداری شود تا از نفوذ رطوبت به آن جلوگیری شود.
در صورت تماس باریم سولفات با رطوبت، این ماده به تدریج حل میشود و میتواند باعث آلودگی محیط زیست شود.
بسته بندی سولفات باریم گرید آزمایشگاهی در وزن ۵ کیلوگرم، ۱ کیلوگرم یا کمتر از یک کیلوگرم با برندهای متفاوت به فروش میرسد. قیمت باریم سولفات صنعتی و باریم سولفات آزمایشگاهی متفاوت است و بستگی به شرکت تولید کننده دارد.
شرایط ذخیره و نگهداری باریم سولفات
- دمای ذخیره: 20-30 درجه سانتیگراد
- رطوبت نسبی: کمتر از 60%
- نور: نور مستقیم خورشید
- خطرات: سمی




خطرات و موارد ایمنی باریم سولفات
بر اساس برگه اطلاعات ایمنی سولفات باریم، هیچ خطر واکنشهای شدید برای این ماده ثبت نشده است. در شرایط محیطی، این ترکیب معدنی، پایدار بوده و در صورتی که از تشکیل گرد و غبار آن در انبار جلوگیری شود، مادهای بی خطر است. پلیمریزاسیون خطرناک یا احتراق اشتعال برای این ترکیب رخ نمیدهد.
تمام کارگران و افرادی که با این ماده سروکار دارند باید از تجهیزات محافظ شخصی نظیر ماسک، دستکش و لباس کار استفاده کنند. استفاده از عینک ایمنی نیز پیشنهاد میشود؛ چرا که ممکن است غبارات بسیار ریز، چشم را تحریک کند. از استنشاق غبارات پراکنده در فضا ناشی از این ماده جداً خودداری کنید.

عوارض جانبی سولفات باریم
عوارض جانبی سولفات باریم معمولاً خفیف و موقتی هستند.
شایعترین عوارض جانبی سولفات باریم عبارتند از:
- گرفتگی خفیف معده
- تهوع
- استفراغ
- مدفوع شل یا یبوست خفیف
در موارد نادر،باریم سولفات میتواند باعث عوارض جانبی جدیتری مانند موارد زیر شود:
- انسداد روده
- آپاندیسیت
- آماس ریوی
- تغییرات در ضربان قلب
در صورت بروز هر یک از این عوارض جانبی، باید بلافاصله به پزشک مراجعه کرد.
چگونگی بازار جهانی خرید و فروش باریم سولفات

بازار جهانی خرید و فروش باریم سولفات یک بازار رقابتی است که توسط عرضه و تقاضا تعیین میشود. عرضه باریم سولفات عمدتاً توسط کشورهای چین، هند، و ایالات متحده تأمین میشود. تقاضا برای باریم سولفات نیز عمدتاً توسط صنایع پزشکی، کاغذسازی، رنگ سازی، لاستیک سازی، و نفت و گاز تأمین میشود.
در سال 2022، بازار جهانی خرید و فروش باریم سولفات ارزشی بالغ بر 2.5 میلیارد دلار داشت.
انتظار میرود که بازار جهانی خرید و فروش باریم سولفات تا سال 2027 با نرخ رشد سالانه 3.5 درصد به ارزش 3.2 میلیارد دلار برسد. این رشد عمدتاً ناشی از عواملی مانند رشد جمعیت و افزایش هزینههای مراقبتهای بهداشتی، رشد صنعت کاغذسازی، رنگ سازی، لاستیک سازی، و نفت و گاز، و تمرکز تولیدکنندگان باریم سولفات بر تولید محصولات با کیفیت بالا و مقرون به صرفه خواهد بود.

