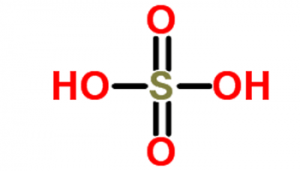
اسید سولفوریک (هیدروژن سولفات یا جوهر گوگرد) که به عنوان “روغن ویتریول” نیز شناخته میشود، یک اسید معدنی است که از عناصر گوگرد، اکسیژن و هیدروژن تشکیل شده است. فرمول شیمیایی آن به صورت H2SO4 نوشته میشود.سولفوریک اسید، مایعی بی رنگ، بی بو و چسبناک است که در آب، محلول است و از طریق واکنشهایی که بسیار گرمازا هستند، سنتز میشود. با هر درصدی در آب حل میشود و پی اچ (pH) این اسید ۰٫۵ میباشد. این ماده دارای مولکولهای قطبی است که میتوانند با یکدیگر پیوند هیدروژنی برقرار کنند. پس اسید سولفوریک مایعی است با نقطه جوش بالا و هم چنین یک مایع ویسکوز (دارای گرانروی زیاد) محسوب میشود. همین شرایط مولکولی باعث میشوند که اسید سولفوریک به خوبی در آب حل شود و محلولهای اسیدی مختلف تولید کند.
اسید سولفوریک اسیدی معدنی و بسیار قوی است که به طور طبیعی در گازهای خارج شده از آتشفشان وجود دارد و با هر درصدی در آب حل میشود. واکنش آن با آب به شدت گرمازا است بههمین دلیل باید از اضافه کردن یکبارهی آب به آن اجتناب کرد. اسید سولفوریک میل ترکیبی زیادی با آب دارد به طوریکه در واکنش با سایر مواد، هیدروژن و اکسیژن آنها را به صورت آب جدا میکند. اسید سولفوریک خورنده است و قسمت عمدهای از باران اسیدی را تشکیل میدهد. قطرات آب به هنگام بارش با آلایندههای کارخانه ها و خودروها که در هوا معلق هستند واکنش میدهند و تولید اسید میکنند. اسید سولفوریک با فلزات واکنش میدهد و هر چه دما بالاتر رود میزان این واکنش بیشتر خواهد شد اما بر روی جیوه و سرب تاثیری ندارد. اسید سولفوریک در لیست مواد خطرناک قرار گرفته است.
خرید اسیدسولفوریک
برای خرید آنلاین اسید سولفوریک با بهترین قیمت و تضمین کیفیت از بهترین برندهای موجود بازار از فروشگاه معتبر ایآز بازدید نمائید
تاریخچه کشف اسید سولفوریک (هیدروژن سولفات)
اسید های معدنی از دوران باستان شناخته شده هستند، اسید سولفوریک از حدود قرن سیزدهم مورد استفاده کیمیاگران قرار گرفته است. این اسید ماده ای شیمیایی بود که از مدت ها قبل از اینکه کاملاً کشف شود، شناخته شده و مورد استفاده قرار می گرفت. با این وجود در قرن هفدهم، با سوزاندن مخلوطی از گوگرد و نمک پتاسیم یا نیترات پتاسیم، اسید سولفوریک در مقیاس صنعتی تولید می شد که نتیجه آن فرمول آشنای H۲SO۴ است. این اسید یکی از اسیدهای معدنی قوی در کنار اسید کلریدریک و نیتریک است.
اسید سولفوریک اکنون از دی اکسید گوگرد در یک فرآیند کاتالیزوری که برای اولین بار در دهه ۱۸۳۰ ابداع شد، ساخته می شود اما نتیجه همان است،یک اسید قوی که بسیار خورنده است و در صورت مخلوط شدن با آب مقدار قابل توجهی گرما تولید می کند. به همین دلیل است که همیشه این اسید باید به آب اضافه شود زیرا برعکس این عمل باعث پاشیده شدن اسید می شود که اسیب زیادی در پی دارد.
جدول مشخصات، خواص و ویژگی های اسید سولفوریک
| نام ماده | اسیدسولفوریک (Sulfuric acid) |
|---|---|
| فرمول مولکولی | H₂SO₄ |
| جرم مولکولی | ۹۸.۰۷۹ g/mol |
| چگالی (دانسیته) | ۱.۸۳ g/cm³ |
| نقطه جوش | ۳۳۷ °C |
| نقطه ذوب | ۱۰ °C |
| حلالیت | حلپذیری کامل (گرماده) انتالپی منفی |
| دیگر نام ها | جوهر گوگرد |
تولید اسید سولفوریک

اسید سولفوریک مانند سایر ترکیب های شیمیایی به صورت طبیعی در طبیعت وجود دارد . اسید سولفوریک به صورت طبیعی در گازهایی که از آتشفشان ها خارج می شود وجود دارد . همچنین سولفوریک اسید بخش زیادی از باران های اسیدی را تشکیل می دهد . اما این ماده شیمیایی پرکاربرد در آزمایشگاه به روش های مختلف نیز می تواند تولید شود و در اختیار همگان قرار گیرد .
روش اول : اسید سولفوریک از ترکیب گاز گوگرد دی اکسید SO2 و آب اکسیژنه H2O2 تولید می شود . SO2 توانایی حل شدن در آب اکسیژنه را به خوبی دارد . پس از انجام واکنش ، می توان اسید سولفوریک را استخراج کرد . تولید اسید سولفوریک باید در محیط آزمایشگاهی مجهز و استاندارد صورت بگیرد .
روش دوم : اسید سولفوریک به روش مجاورت نیز تولید می شود . این واکنش به شدت گرماده می باشد . برای انجام این فرآیند در ابتدا می بایست گوگرد و اکسیژن را در مجاورت یک دیگر قرار دهیم تا گوگرد دی اکسید تولید شود . سپس گوگرد دی اکسید را با اکسیژن و حضور یک کاتالیزگر وارد واکنش تا SO3 تولید شود . (این واکنش برگشت پذیر بوده بخاطر بی نظمی این واکنش) سپس در دمای بسیار بالا گوگرد تری اکسید SO3 با آب واکنش داده می شوند و اسید سولفوریک به دست می آید .
کاربردهای اسید سولفوریک
اسید سولفوریک یکی از مهمترین مواد شیمیایی اولیه برای صنایع است که تولید جهانی آن هر ساله افزایش پیدا می کند. از آنجا که این ماده در صنعت بسیار پرکاربرد است به آن لقب« سلطان مواد شیمیایی» دادهاند. به دلیل نیاز بالای جامعه به خرید این اسید به طور تقریبی سالیانه در حدود ۲۵۰ میلیون تن اسید سولفوریک در جهان تولید می شود. این ماده در صنایعی نظیر تولید مواد شوینده،تولید کودهای شیمیایی، تولید رنگ، داروسازی، اسید باتری، صنعت آبکاری و … کاربرد دارد که در ادامه به توضیح برخی از آن می پردازیم.
1_اسید سولفوریک در تولید کودهای شیمیایی: تولید کود شیمیایی را می توان از مهم ترین کاربردهای سولفوریک اسید دانست. ترکیب سولفوریک اسید در کودهای شیمیایی باعث جبران کمبود گوگرد خاک می شود. همچنین این ماده نفوذپذیری خاک را افزایش میدهد.
2_اسید سولفوریک در تولید مواد شوینده: به علت خاصیت خورندگی و حل کردن چربی، از اسید سولفوریک برای تولید مواد شوینده خانگی و صنعتی استفاده می شود.
3_اسید سولفوریک در تولید رنگ های شیمیایی: اسید سولفوریک ماده مهم برای تولید رنگهای نقاشی می باشد.
4_اسید سولفوریک در پالایشگاه های نفتی: برای تصفیه پساب های نفتی و خنثی کردن ترکیبات بازی از اسید سولفوریک استفاده می شود.
5_اسید سولفوریک در دستگاه تصفیه آب معکوس: به دلیل خاصیت خورندگی و پاک کنندگی اسید سولفوریک از آن برای از بین بردن رسوب های دستگاه تصفیه آب استفاده می شود.
6_اسید سولفوریک در تولید مواد منفجره: در ساخت مواد منفجره از نیتروگلیسیرین و اسید هایی مانند اسید سولفوریک استفاده می شود.
7_اسید سولفوریک در چرم سازی: به دلیل خاصیت خورندگی اسید سولفوریک ، از آن برای شستوشوی چرم ها و از بین بردن چربی ها استفاده می کنند .










اهمیت استراتژیک اسید سولفوریک
همانطور که ذکر شد، عمده کاربرد اسید سولفوریک در تولید کودهای فسفاته است. اهمیت استراتژیک اسید سولفوریک نیز در همین راستاست. با رشد روزافزون جمعیت جهان و محدودیت زمین های کشاورزی، میزان بهره وری و راندمان تولید محصول از خاک به ازای هر واحد، ضرورتا باید افزوده شود تا بتواند پاسخگوی رشد فزاینده جمعیت باشد. امروزه این کار دیگر با کودهای حیوانی انجام نمی شود. چرا که کودهای حیوانی تنها فیزیک خاک را تغییر می دهند و خاک را برای رشد آماده می کنند، اما از نظر مواد مغذی برای گیاه بسیار فقیر هستند. برای بالا بردن بهره وری خاک، استفاده از کودهای شیمیایی ضرورت شناخته شده ای است. همانطور که در بخش موارد کاربرد ذکر شد، اسید سولفوریک در تولید کودهای پر مصرف از جمله کودهای فسفاته و نیز کود سولفات آمونیوم مورد استفاده قرار می گیرد و در این کاربردها نیز قابل جایگزینی با ماده دیگری نیست ، از این نظر بسیار حائز اهمیت است.
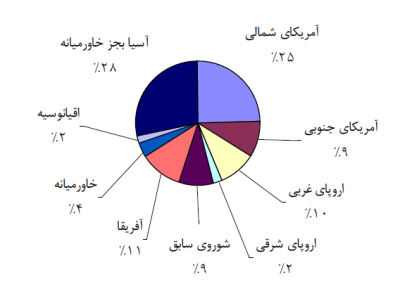
سهم تولید اسید سولفوریک در هر یک از مناطق عمده جهان
شرایط نگهداری اسید سولفوریک(هیدروژن سولفات)
برای پایین نگه داشتن غلظت بخارات منتشر شده از هیدروژن سولفات، باید انبارهای نگهداری مخازن و بشکهها دارای تهویه قوی باشند. کارگرانی که با این اسید سروکار دارند باید تمام اقدامات ایمنی را رعایت کنند و پوشش کامل را داشته باشند.
عینک، دستکشهای لاستیکی چند لایه، ماسک چند لایه، لباسهای ضخیم و آستین بلند، همیشه و همیشه مهم هستند. در صورت امکان، پوشیدن چکمههای مخصوص محل کار هم توصیه میشود. کارگران باید به خوبی برای کار با این اسید و نحوه برخورد با حوادث ناشی از آن آموزش دیده باشند.
در صورت نگهداری در ظرفهای غیر واکنش پذیر، درب ظرف را محکم بسته نگه دارید. مخازن نگهداری سولفوریک اسید نباید به هیچ عنوان فلزی باشد؛ اسید با فلز واکنش داده وهیدروژن تخلیه میشود.

بسته بندی و ظروف نگهداری اسید سولفوریک
بسته بندیهای اسید سولفوریک مرک برای کاربردهای آزمایشگاهی معمولاً در حجم ۵/۲ لیتری در ظروف شیشهای، یا حجمهای ۱ لیتری، ۵ لیتری، ۱۰ لیتری و ۲۰ لیتری در ظروف پلی اتیلنی ارائه میشود.
بسته بندی سولفوریک اسید صنعتی و خوراکی برای مصرف در صنعت عموماً در بشکههای پلی اتیلنی با حجم ۲۲۰ لیتری میباشد. حمل و نقل به صورت فلهای هم امکان پذیر است. قیمت خرید اسید سولفوریک در هر بسته بندی، متفاوت است.
چگونگی استفاده ایمن از اسید سولفوریک
هنگام استفاده از اسید خالص در محیط آزمایشگاهی یا صنعتی، یا هنگام استفاده از محصولاتی که حاوی اسید سولفوریک غلیظ هستند، اولویت بندی اقدامات احتیاطی ایمنی مهم است. هنگام استفاده از این اسید باید از تجهیزات محافظتی زیر استفاده شود:
- ماسک
- دستکش بلند لاستیکی
- چکمه و کفش ایمنی مخصوص
- عینک ایمنی شیمیایی
- محافظ صورت

کمک های اولیه پس از مواجهه با اسید سولفوریک
قرار گرفتن در معرض این ماده می تواند به صورت تماس با پوست / بدن، بلع یا استنشاق بخارات صورت گیرد. هر نوع مواجهه می تواند خطرات جدی برای سلامتی شما داشته باشد و باید فوراً و به طور مناسب توسط یک پزشک متخصص کنترل شود تا آسیب ها و خطرات سلامتی را به حداقل برسانید.
تماس با پوست
اگر این اسید با پوست شما تماس گرفت، بلافاصله ناحیه آسیب دیده را به آرامی با آب ولرم حداقل برای ۳۰ دقیقه بدون وقفه شستشو دهید. بلافاصله به دنبال مراقبت های پزشکی باشید
تماس با چشم
اگر این اسید به چشم شما وارد شد، بلافاصله چشم (ها) را حداقل برای ۳۰ دقیقه با آب بشویید. بلافاصله به دنبال مراقبت های پزشکی باشید.
بلع
در صورت مصرف خوراکی بلافاصله دهان خود را با آب بشویید. استفراغ ایجاد نکنید. دهان خود را به طور مداوم با آب بشویید و در اسرع وقت به دنبال مراقبت های پزشکی باشید.
استنشاق
در صورت استنشاق آئروسل های این اسید، بلافاصله به دنبال هوای تازه و مراقبت های پزشکی باشید.

