اسید اگزالیک، به عنوان اسید اتان دی اوئیک شناخته میشود، یک ترکیب آلی طبیعی است. در گیاهان مختلفی مانند اسفناج، ریواس و ترشک یافت میشود. با این حال، میتوان آن را به صورت مصنوعی از طریق فرآیندهای شیمیایی نیز تولید کرد. این ترکیب از کریستالهای بیرنگ یا یک پودر سفید با طعم ترش تشکیل شده است. فرمول شیمیایی آن C2H2O4 است. اسید اگزالیک در آب بسیار محلول است و در صورت حل شدن یون اگزالات را تشکیل میدهد.
خرید اسید اگزالیک
برای خرید آنلاین اسید اگزالیک با بهترین قیمت و تضمین کیفیت از بهترین برندهای موجود بازار از فروشگاه معتبر ایآز بازدید نمائید.
فهرست محتوا
نگاهی به تاریخچه کشف اسید اگزالیک
اسید اگزالیک سابقهای طولانی و دیرینه دارد که به دوران باستان باز میگردد. اولین بار در برگهای گیاه ترشک چوبی (Rumex acetosa) کشف شد. نام “اگزالیک” از کلمه یونانی “oxalis” به معنی “ترشک” گرفته شده است.
در طول قرن ها، خواص اسید اگزالیک مورد مطالعه و بررسی قرار گرفته است. دانشمندان اولیه مانند جابر بن حیان و جرج پارکر در قرن های هشتم و شانزدهم میلادی به ترتیب به خواص اسیدی و سفید کنندگی این ماده پی بردند.
در قرن هجدهم، شیمیدان سوئدی به نام “کارل ویلهلم شیل” اسید اگزالیک را از برگ های ترشک چوبی جدا کرد و آن را به عنوان یک ترکیب شیمیایی مجزا شناسایی کرد.
منابع طبیعی اسید اگزالیک
برگهای ریواس: یکی از منابع رایج اسید اگزالیک، برگهای ریواس است. این برگها به طور طبیعی حاوی سطوح بالایی از این اسید هستند. با این حال، مصرف مقادیر زیاد برگهای ریواس خام میتواند سمی باشد.
اسفناج: اسفناج منبع دیگری از اسید اگزالیک است. در حالی که اسفناج یک سبزی مغذی است، پختن یا جوشاندن آن میتواند به کاهش میزان اسید اگزالیک موجود در آن کمک کند.
سایر منابع : سبزی چغندر ، برگ چغندر ، جعفری ، کاکائو ، چای سیاه ، بادام زمینی ، سبوس گندم ، لوبیا
نکاتی برای مصرف اسید اگزالیک
- اگر مستعد ابتلا به سنگ کلیه هستید، مصرف اسید اگزالیک را محدود کنید.
- از مصرف بیش از حد برگهای ریواس خام خودداری کنید.
- اسفناج را قبل از مصرف بپزید یا بجوشانید.
- به طور کلی، تنوع در رژیم غذایی خود را حفظ کنید و از مصرف بیش از حد یک نوع غذا خودداری کنید.
ساختار اسید اگزالیک
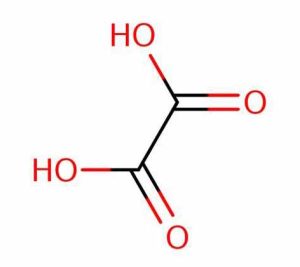
اسید اگزالیک (C2H2O4) یک ترکیب آلی با ساختار ساده و متقارن است . اگزالیک اسید یا اکسالیک اسید و نیز جوهر ترشک نامهای خاص دی اتانوئیک اسید HOOC-COOH می باشند.
این اسید از دو گروه کربوکسیل (-COOH) تشکیل شده که توسط یک اتم کربن به هم متصل شدهاند .در مولکول اسید اگزالیک ، پیوندهای کووالانسی بین اتمها وجود دارد .
پیوند بین اتم کربن و اتم اکسیژن در گروه کربوکسیل (C-O) پیوندی قطبی است . پیوند بین اتم کربن و اتم هیدروژن در گروه کربوکسیل (C-H) پیوندی غیرقطبی است .
تولید اسید اگزالیک
اسید اگزالیک (C2H2O4) به طور طبیعی در برخی از گیاهان مانند اسفناج، چغندر و ریواس یافت میشود. اما برای مصارف صنعتی، اسید اگزالیک به صورت مصنوعی تولید میشود.
روشهای تولید:
- اکسیداسیون اتیلن گلیکول: این روش رایجترین روش تولید اسید اگزالیک است. در این روش، اتیلن گلیکول با اسید نیتریک و یا پتاسیم پرمنگنات اکسید میشود.
- اکسیداسیون گلوکز: در این روش، گلوکز با اسید نیتریک و یا هوا اکسید میشود.
- هیدرولیز اگزالاتها: اگزالاتها نمکهای اسید اگزالیک هستند. در این روش، اگزالاتها با اسیدهای قوی مانند اسید سولفوریک هیدرولیز میشوند و اسید اگزالیک تولید میشود.
مراحل تولید اسید اگزالیک
- مرحله آماده سازی: در این مرحله، مواد اولیه مانند اتیلن گلیکول و اسید نیتریک تصفیه و آماده میشوند.
- مرحله اکسیداسیون: در این مرحله، مواد اولیه در یک راکتور با هم مخلوط شده و تحت شرایط خاص دما و فشار اکسید میشوند.
- مرحله جداسازی: در این مرحله، اسید اگزالیک از محلول واکنش جدا میشود.
- مرحله خالص سازی: در این مرحله، اسید اگزالیک خالص سازی میشود.
- مرحله خشک کردن: در این مرحله، اسید اگزالیک خشک میشود.
تولید اسید اگزالیک یک فرآیند شیمیایی پیچیده است و باید توسط افراد متخصص انجام شود
مشخصات اسید اگزالیک
| ویژگی | مقدار |
|---|---|
| نام | اسید اگزالیک |
| فرمول شیمیایی | C2H2O4 |
| جرم مولی | 90.03 گرم بر مول |
| شکل ظاهری | بلورهای سفید |
| حلالیت در آب | 9.5 گرم در 100 گرم آب در 20 درجه سانتیگراد |
| نقطه ذوب | 189.5 درجه سانتیگراد |
| نقطه جوش | 101.5 درجه سانتیگراد |
| چگالی | 1.9 گرم بر سانتیمتر مکعب |
| اسیدیته | قوی |
اسید اگزالیک در صورت گرم شدن تجزیه می شود. دی اکسید کربن و مونوکسید کربن. این واکنش را می توان با معادله زیر نشان داد:
C2H2O4 → CO2 + CO + H2
تجزیه اسید اگزالیک را می توان با استفاده از کاتالیزوری مانند اسید سولفوریک تسریع کرد. این واکنش را می توان با معادله زیر نشان داد:
C2H2O4 + H2SO4 → CO2 + CO + H2O + SO2
تجزیه اسید اگزالیک یک واکنش گرمازا است. به این معنی که گرما آزاد می کند. این واکنش را می توان برای تولید گرما در کاربردهایی مانند گرمایش و پخت و پز استفاده کرد.
تجزیه اسید اگزالیک نیز یک واکنش ردوکس است. به این معنی که اتم های کربن در اسید اگزالیک اکسید می شوند. این واکنش را می توان برای تولید دی اکسید کربن در کاربردهایی مانند تولید گازدار و تصفیه آب استفاده کرد.
کاربردهای اسید اگزالیک
اسید اگزالیک با خواص منحصر به فرد و تطبیقپذیری خود، کاربردهای متعددی در صنایع مختلف پیدا میکند. بیایید برخی از روشهای جالب استفاده از اسید اگزالیک را بررسی کنیم:
کاربردهای صنعتی اسید اگزالیک
- عامل سفید کننده: اسید اگزالیک به دلیل خاصیت اسیدی قوی، به عنوان سفید کننده چوب، فلزات و سایر سطوح به کار میرود.
- عامل پاک کننده: این اسید در پاک کردن لکههای زنگ زدگی، جرم و رسوب از سطوح مختلف مانند کاشی، سرامیک، پارچه و فلزات کاربرد دارد.
- صنعت نساجی: در صنعت نساجی، از اسید اگزالیک برای رنگرزی و چاپ پارچه استفاده میشود. به عنوان مثال، برای تثبیت رنگ در رنگرزی با استفاده از رنگهای کاتیونی به کار میرود.
- صنعت چرم: اسید اگزالیک در دباغی چرم برای از بین بردن مو و چربی از پوست حیوان و همچنین برای نرم کردن چرم استفاده میشود.
- صنعت کاغذ: در صنعت کاغذ، از اسید اگزالیک برای سفید کردن خمیر کاغذ و همچنین برای بهبود کیفیت کاغذ استفاده میشود.
- صنعت کاشی و سرامیک: اسید اگزالیک در تولید کاشی و سرامیک برای تمیز کردن سطح کاشی و سرامیک قبل از لعاب کاری استفاده میشود.
کاربردهای دیگر اسید اگزالیک
- صنعت غذایی: اسید اگزالیک به عنوان طعم دهنده ترش در برخی از مواد غذایی مانند نوشابه، آبنبات و سسها به کار میرود.
- پزشکی: این اسید در برخی از داروها مانند داروهای ضد انعقاد خون و داروهای ضد سنگ کلیه استفاده میشود.
- زنبورداری: اسید اگزالیک برای درمان کنه واروا در زنبور عسل استفاده میشود.طبق بررسی ها استفاده از این ماده سالی دوبار انجام می شود،یک بار در اواخر تابستان و بار دوم با شروع زمستان،دلیل این امر نیز مقارن شدن این فصول با زمان تولید مثل زنبورها می باشد.ناگفته نماند که اسید هایی همچون، سیتریک اسید ، اسید فرمیک، استیک و لاکتیک اسید نیز می توانند در مبارزه با این موجودات تاثیر مثبتی داشته باشند.

خطرات و ایمنی کار با اسید اگزالیک
اسید اگزالیک یک ماده سمی است و در صورت عدم استفاده صحیح می تواند خطرناک باشد. خطرات مرتبط با اسید اگزالیک عبارتند از:
تحریک: اسید اگزالیک می تواند باعث تحریک پوست، چشم و غشاهای مخاطی شود.
سوختگی: در صورت تماس اسید اگزالیک با پوست برای مدت طولانی، می تواند باعث سوختگی شود.
مسمومیت: بلع اسید اگزالیک می تواند منجر به مسمومیت شود. علائم مسمومیت با اسید اگزالیک عبارتند از درد شکم، اسهال، استفراغ، ضعف و تشنج. در موارد شدید، مسمومیت با اسید اگزالیک می تواند منجر به مرگ شود.
سنگ کلیه: اسید اگزالیک می تواند با کلسیم در بدن ترکیب شود و سنگ کلیه ایجاد کند.
در اینجا اقدامات احتیاطی ایمنی برای کار با اسید اگزالیک آورده شده است:
همیشه از تجهیزات حفاظتی شخصی مانند دستکش، عینک و ماسک استفاده کنید.در صورت تماس اسید اگزالیک با پوست، بلافاصله با آب فراوان بشویید.همچنین در مورد تماس اسید اگزالیک با چشم، بلافاصله چشم ها را با آب جاری به مدت 15 دقیقه بشویید و برای مراقبت های پزشکی مراجعه کنید.
اسید اگزالیک را در مکانی خنک، خشک و دور از دسترس کودکان و حیوانات خانگی نگهداری کنید.در صورت بلع اسید اگزالیک، فوراً با پزشک یا مرکز کنترل سم تماس بگیرید.
بازار جهانی اسید اگزالیک

چین را می توان بزرگترین صادر کننده و تولید کننده این ماده شیمیایی در جهان دانست، این کشور بیش از 25 درصد از میزان اسید اگزالیک تولیدی خود را به کشورهایی همچون ایالات متحده آمریکا، کشورهای آسیایی همچون ژاپن و اندونزی و همچنین بخشی از اروپا صادر می کند.
کاربرد این اسید در نساجی، آماده سازی فلزات، ساخت مواد شیمیایی و دارویی، صنایع چرم سازی و… باعث افزایش میزان فروش اسید اگزالیک در بازار های جهانی گردید. جالب است بدانید در سال 2016 بیشترین حجم خرید اسید اگزالیک مربوط به صنایع دارویی بوده است و انتظار می رود تا سال 2021 با رشد سالیانه 3.4% جایگاه خود را حفظ نماید.
انبار و نگهداری از اسید اگزالیک
همواره باید اسید اگزالیک را در ظروف محکم و دارای برچسب، دور از مواد ناسازگار مانند بازهای قوی یا اکسیدکنندهها نگهداری کنید. اگزالیک اسید را معمولا در بطریهای شیشهای نگهداری میکنند. دلیل این امر آن است که شیشه با اسید واکنش نمیدهد و از آن در برابر رطوبت و هوا محافظت میکند.
همچنین، آن را از دسترس کودکان و حیوانات خانگی دور نگهدارید. شما باید با روشهای صحیح دفع مواد زائد از اسید اگزالیک آشنا شوید. حتما از مقررات محل کار خود درباره دفع زبالههای خطرناک پیروی کنید تا به محیط زیست آسیبی وارد نشود.




مطمئن شوید که اسید اگزالیک را در یک مکان خشک و خنک نگهداری میکنید. مهم است که این ماده را با نقره، اوره و کلرید ، یک جا قرار ندهید. به دلیل خصوصیت اسیدی این ماده، حتما از قرار گرفتن در محیط های قلیایی و همچنین فلزات مانند منیزیم، پتاسیم و سدیم خودداری کنید. در نظر داشته باشید این ماده در مواجه شدن با اسید فرمیک خراب می شود.
از نگهداری این ترکیب در مجاورت موادی که با این ترکیب گاز سمی تولید میکنند، مانند سدیم سیانید و سولفید آهن اجتناب کنید. از نگهداری جامدات یا اسیدهای اکسید کننده در مجاورت این اسید خودداری کنید.محلول این ماده تا یک هفته در دمای اتاق باقی میماند و در صورت نگهداری در یخچال، حدود چند ماه دوام دارد. اگر محلول تغییر رنگ داد یا بوی به خصوصی داد، آن را به سرعت دور بریزید.