آمونیوم نیترات (NH4NO3) یک ترکیب شیمیایی با فرمول شیمیایی NH4NO3 است. این ترکیب یک ترکیب معدنی سفید رنگ است که به صورت جامد کریستالی یا پودر وجود دارد. آمونیوم نیترات یک ماده منفجره است و همچنین کاربردهای زیادی در کشاورزی و صنعت دارد.
خرید آمونیوم نیترات
برای خرید آنلاین آمونیوم نیترات با بهترین قیمت و تضمین کیفیت از بهترین برندهای موجود بازار از فروشگاه معتبر ایآز بازدید نمائید
فهرست مطالب
1_تاریخچه کشف آمونیوم نیترات
تاریخچه کشف نیترات آمونیوم به قرن 13 میلادی باز می گردد. در آن زمان، دانشمندان عرب از نیترات آمونیوم به عنوان یک ماده شیمیایی در ساخت مواد منفجره و کود استفاده می کردند.
در سال 1646، دانشمند آلمانی، یوهان رودولف گلبرشت، نیترات آمونیوم را به عنوان یک ترکیب شیمیایی جداگانه شناسایی کرد. او نشان داد که نیترات آمونیوم از واکنش آمونیاک و اسید نیتریک تشکیل می شود.
در سال 1799، دانشمند فرانسوی، نیکلاس-لوئی فرانسوا دو لاکلو، نشان داد که نیترات آمونیوم یک ماده منفجره است. او با ترکیب نیترات آمونیوم با گوگرد و زغال، یک ماده منفجره جدید به نام باروت تهیه کرد.
در سال 1867، دانشمند آمریکایی، جیمز مونرو آمونس، یک روش صنعتی برای تولید نیترات آمونیوم ابداع کرد. این روش با استفاده از آمونیاک و اسید نیتریک، نیترات آمونیوم را به صورت جامد تولید می کرد.
در دهه 1900، تولید نیترات آمونیوم به سرعت افزایش یافت. این افزایش به دلیل نیاز به نیترات آمونیوم در تولید مواد منفجره و کود بود.
در حال حاضر، نیترات آمونیوم یکی از پرکاربردترین ترکیبات شیمیایی در جهان است. این ترکیب کاربردهای زیادی در کشاورزی، صنعت و ساخت و ساز دارد.

2_آمونیوم نیترات باز است یا اسید؟
نیترات آمونیوم نمک است اما محلول اسیدی است زیرا نمکی با پایه ضعیف (هیدروکسید آمونیوم) و اسید نیتریک سنگین است.
نیترات آمونیوم یک ماده شیمیایی با فرمول NH4NO3 است. این ترکیب در آب به راحتی حل می شود و یک محلول اسیدی ضعیف تولید می کند. بنابراین، نیترات آمونیوم یک اسید ضعیف است.
در واقع، نیترات آمونیوم از ترکیب یک اسید قوی (اسید نیتریک) و یک باز ضعیف (آمونیاک) تشکیل شده است. در نتیجه، این ترکیب دارای ماهیت اسیدی است.
3_ساختار آمونیوم نیترات
یون آمونیوم از یک اتم نیتروژن مرکزی و چهار اتم هیدروژن تشکیل شده است. اتم نیتروژن دارای بار مثبت یک است و چهار اتم هیدروژن دارای بار مثبت یک هستند.
یون نیترات از یک اتم نیتروژن مرکزی و سه اتم اکسیژن تشکیل شده است. اتم نیتروژن دارای بار منفی یک است و سه اتم اکسیژن دارای بار منفی دو هستند.
نیترات آمونیوم یک ترکیب جامد است که به صورت کریستال یا پودر وجود دارد. این ترکیب در آب بسیار محلول است و می تواند تا 120 گرم در 100 میلی لیتر آب حل شود.
4_جدول خواص فیزیکی و شیمیایی آمونیوم نیترات
| ویژگی | مقدار |
|---|---|
| فرمول شیمیایی | NH4NO3 |
| جرم مولکولی | 80.06 گرم بر مول |
| ظاهر | جامد بی رنگ یا سفید |
| نقطه ذوب | 169.6 درجه سانتیگراد |
| نقطه جوش | 210 درجه سانتیگراد |
| چگالی | 1.72 گرم بر سانتی متر مکعب |
| حلالیت در آب | 125 گرم در 100 میلی لیتر آب در 20 درجه سانتیگراد |
| pH | 8.5 |
| اکسیداسیون | +5 |
| کاهش | -3 |

5_واکنش های شیمیایی آمونیوم نیترات
- واکنش با آب: نیترات آمونیوم در آب به راحتی حل می شود و یک محلول اسیدی ضعیف تولید می کند.
NH4NO3 + H2O → NH4OH + HNO3
NH4NO3 + HCl → NH4Cl + HNO3
- واکنش با باز: نیترات آمونیوم با باز ها واکنش می دهد و نیترات ها و آمونیوم هیدروکسید تولید می کند.
NH4NO3 + NaOH → NaNO3 + NH4OH
- واکنش با فلزات: نیترات آمونیوم با فلزات واکنش می دهد و نیترات ها و گاز هیدروژن تولید می کند.
NH4NO3 + Zn → Zn(NO3)2 + H2
- واکنش با سوخت های آلی: نیترات آمونیوم با سوخت های آلی واکنش می دهد و می تواند باعث انفجار شود.
NH4NO3 + C → CO2 + N2 + H2O6_روش تولید آمونیوم نیترات
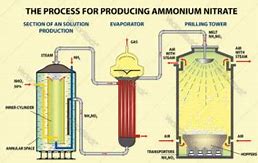
روش تولید نیترات آمونیوم به دو دسته کلی تقسیم می شود:
- روش آمونیاک-اسید: در این روش، آمونیاک و اسید نیتریک با یکدیگر واکنش داده و نیترات آمونیوم تولید می کنند. این روش رایج ترین روش تولید نیترات آمونیوم است.
- روش آمونیاک-نمک نیترات: در این روش، آمونیاک و نمک نیترات با یکدیگر واکنش داده و نیترات آمونیوم تولید می کنند. این روش نسبت به روش آمونیاک-اسید، کمتر مورد استفاده قرار می گیرد.
روش آمونیاک-اسید
در این روش، آمونیاک و اسید نیتریک با یکدیگر واکنش داده و نیترات آمونیوم تولید می کنند. این واکنش به صورت زیر انجام می شود:
NH3 + HNO3 → NH4NO3
برای انجام این واکنش، آمونیاک و اسید نیتریک را به صورت رقیق در دو ظرف جداگانه وارد می کنند. سپس، این دو ظرف را به یکدیگر متصل کرده و مخلوط می کنند. در نتیجه این واکنش، نیترات آمونیوم به صورت جامد تولید می شود.
برای جداسازی نیترات آمونیوم از محلول، می توان از روش های مختلفی مانند فیلتراسیون، تبلور یا رسوب استفاده کرد.
روش آمونیاک-نمک نیترات
در این روش، آمونیاک و نمک نیترات با یکدیگر واکنش داده و نیترات آمونیوم تولید می کنند. این واکنش به صورت زیر انجام می شود:
NH3 + NaNO3 → NH4NO3 + NaOH
برای انجام این واکنش، آمونیاک و نمک نیترات را به صورت رقیق در دو ظرف جداگانه وارد می کنند. سپس، این دو ظرف را به یکدیگر متصل کرده و مخلوط می کنند. در نتیجه این واکنش، نیترات آمونیوم به صورت جامد تولید می شود.
برای جداسازی نیترات آمونیوم از محلول، می توان از روش های مختلفی مانند فیلتراسیون، تبلور یا رسوب استفاده کرد.
7_عوامل موثر بر تولید آمونیوم نیترات
عوامل مختلفی بر تولید نیترات آمونیوم موثر هستند. از جمله این عوامل می توان به موارد زیر اشاره کرد:
- غلظت آمونیاک و اسید نیتریک: غلظت آمونیاک و اسید نیتریک بر سرعت واکنش و میزان تولید نیترات آمونیوم موثر است.
- دمای واکنش: دمای واکنش بر سرعت واکنش و میزان تولید نیترات آمونیوم موثر است.
- فشار واکنش: فشار واکنش بر سرعت واکنش و میزان تولید نیترات آمونیوم موثر است.
- کاتالیزور: استفاده از کاتالیزور می تواند سرعت واکنش را افزایش دهد.
8_کاربردهای آمونیوم نیترات
نیترات آمونیوم یک ترکیب شیمیایی با کاربردهای متنوع است. این ترکیب در صنایع مختلف از جمله کشاورزی، صنعت و ساخت و ساز کاربرد دارد.
کاربرد نیترات آمونیوم در کشاورزی
نیترات آمونیوم یک کود شیمیایی مهم است. این ترکیب حاوی 34 درصد ازت است که یک ماده مغذی ضروری برای رشد گیاهان است. نیترات آمونیوم به صورت گرانول یا مایع در دسترس است و می توان آن را به خاک اضافه کرد یا با آب مخلوط کرد.
نیترات آمونیوم یک کود شیمیایی نسبتاً ارزان است و به راحتی در دسترس است. این ترکیب همچنین یک کود شیمیایی پایدار است و به راحتی توسط گیاهان جذب می شود.
کاربرد نیترات آمونیوم در صنعت
نیترات آمونیوم به عنوان یک ماده اولیه در تولید مواد منفجره، مواد شیمیایی و کود استفاده می شود. این ترکیب همچنین به عنوان یک ماده خنثی کننده در تصفیه آب و به عنوان یک ماده ضدعفونی کننده استفاده می شود.
نیترات آمونیوم یک ماده اکسید کننده قوی است و در واکنش های شیمیایی می تواند اکسیژن آزاد کند. این ترکیب همچنین یک ماده با چگالی پایین است و به راحتی قابل حمل است.
کاربرد نیترات آمونیوم در ساخت و ساز
نیترات آمونیوم به عنوان یک ماده افزودنی در بتن و سیمان استفاده می شود. این ترکیب باعث افزایش مقاومت بتن و سیمان در برابر خوردگی می شود.
نیترات آمونیوم یک ماده با قیمت مناسب است و به راحتی در دسترس است. این ترکیب همچنین یک ماده پایدار است و به راحتی با بتن و سیمان ترکیب می شود.
9_مضرات آمونیوم نیترات
همانطور که می دانید نیترات آمونیوم برای سلامتی خطرناک نیست و معمولا در محصولات کود استفاده می شود.نیترات آمونیوم دارای LD۵۰ میلی گرم بر کیلوگرم است، که برای مقایسه می توان گفت که حدود دو سوم نمک خوراکی است. لازم به ذکر است که بدانید نیترات آمونیوم به صورت غیر قابل انفجار به گاز های اکسید نیتروژن و بخار آب تجزیه می شود. با این حال، می توان آن را وادار کرد که به صورت انفجاری تجزیه شود. بنابراین ذخایر بزرگ مواد همچنین به دلیل اکسیداسیون پشتیبان آن ها می تواند خطر آتش سوزی بزرگی را به همراه داشته باشد، وضعیتی که به راحتی می تواند به انفجار تبدیل شود. به عبارتی می توان گفت که انفجارها غیر معمول نیستند. در واقع حوادث نسبتا جزئی در بیشتر سال ها رخ می دهد و چندین انفجار بزرگ و ویرانگر نیز در پی آن اتفاق بیافتد. به عنوان مثال می توان به انفجار Oppau در سال ۱۹۲۱ (یکی از بزرگ ترین انفجار های غیر هسته ای مصنوعی)، فاجعه شهر تگزاس، انفجار های تیانجین در چین، و انفجار بیروت اشاره کرد. جالب است بدانید پروفسور سلا یکی از شیمی دانان بر این باور است که، نیترات آمونیوم به خودی خود قابل حمل است. با این حال، اگر مقدار زیادی مواد برای مدت طولانی در اطراف شما قرار داشته باشد، شروع به پوسیدگی می کند. همچنین او میگوید: «مشکل واقعی این است که با گذشت زمان مقدار کمی رطوبت را جذب می کند و در نهایت به سنگی عظیم تبدیل میشود. این امر آن را خطرناک تر می کند. زیرا در این صورت اگر آتش به آن برسد، واکنش شیمیایی بسیار شدید تر خواهد بود. نیترات آمونیوم می تواند از طریق دو مکانیسم منفجر شود:
• انتقال شوک به انفجار: یک بار انفجاری در داخل یا در تماس با توده نیترات آمونیوم باعث انفجار نیترات آمونیوم می شود. کریوالد، مورگان، اوپائو و تسندرلو نمونه هایی از مضرات آمونیوم نیترات به شمار می رود.
• انتقال باد زدگی به انفجار: انفجار آن ناشی از آتش سوزی به نیترات آمونیوم، یا از مخلوط شدن نیترات آمونیوم با مواد قابل احتراق در طول آتش سوزی است. البته برای انتقال موفقیت آمیز از آتش سوزی به انفجار، آتش باید حداقل تا حدی محدود شود.
10_نحوه ی نگهداری آمونیوم نیترات
نحوه ی نگهداری آمونیوم نیترات به چه صورت می باشد؟ باید به چه نکاتی توجه داشته باشید؟ در این راستا می توان گفت دستورالعمل های ایمنی متعددی برای نگهداری و جابجایی نیترات آمونیوم موجود است. داده های بهداشت و ایمنی در برگه های اطلاعات ایمنی موجود از تامینکنندگان و دولت های مختلف نشان داده میشود.لازم به ذکر است که نیترات آمونیوم خالص نمی سوزد، اما به عنوان یک اکسید کننده قوی، احتراق مواد آلی (و برخی غیر آلی) را پشتیبانی و تسریع می کند. به همبن منظور نباید در نزدیکی مواد قابل احتراق نگهداری شود. البته در نظر داشته باشید با حالی که نیترات آمونیوم در بسیاری از شرایط در دما و فشار محیط پایدار است، ممکن است از یک بار شروع قوی منفجر شود. بنابراین نباید در نزدیکی مواد منفجره قوی یا مواد انفجاری نگهداری شود. نیترات آمونیوم مذاب به شوک و انفجار بسیار حساس است، به ویژه اگر با مواد ناسازگار مانند مواد قابل احتراق، مایعات قابل اشتعال، اسیدها، کلرات ها، کلریدها، گوگرد، فلزات، زغال چوب و خاک اره آلوده شود. شایان ذکر است تماس با مواد خاصی مانند کلرات ها، اسید های معدنی و سولفید های فلزی، می تواند منجر به تجزیه شدید یا حتی شدید شود که می تواند مواد قابل احتراق مجاور را مشتعل کند یا منفجر شود. نیترات آمونیوم پس از ذوب شروع به تجزیه می کند. نگهداری از آمونیوم نیترات باید به گونه ای باشد که نباید در فضای محدود گرم شود. زیرا گرما و فشار حاصل از تجزیه حساسیت به انفجار را افزایش می دهد و سرعت تجزیه را افزایش می دهد. انفجار ممکن است در ۸۰ اتمسفر رخ دهد. آلودگی می تواند این میزان را به ۲۰ اتمسفر کاهش دهد. لازم به ذکر است نیترات آمونیوم دارای رطوبت نسبی بحرانی ۵۹.۴ درصد در ۳۰ درجه سانتی گراد است. در رطوبت بالاتر رطوبت را از جو جذب می کند. بنابراین، نگهداری نیترات آمونیوم در یک ظرف محکم در بسته مهم است. در غیر این صورت، می تواند به یک توده بزرگ و جامد تبدیل شود. جالب است بدانید نیترات آمونیوم می تواند رطوبت کافی برای مایع شدن را جذب کند. همچنین باید گفت که مخلوط کردن نیترات آمونیوم با برخی کود های دیگر می تواند رطوبت نسبی بحرانی را کاهش دهد. پتانسیل استفاده از این ماده به عنوان ماده منفجره، اقدامات نظارتی را برانگیخته است. به عنوان مثال، در استرالیا، مقررات کالاهای خطرناک در آگوست ۲۰۰۵ برای اجرای مجوز در برخورد با چنین موادی اجرایی شد. این نکته حائز اهمیت است که مجوز ها فقط به متقاضیان (صنعت) با تدابیر امنیتی مناسب برای جلوگیری از هرگونه سوء استفاده اعطا می شود. به عبارتی استفاده های اضافی مانند اهداف آموزشی و تحقیقاتی نیز ممکن است در نظر گرفته شود، اما استفاده فردی نخواهد بود. کارمندان افرادی که مجوز برخورد با این ماده را دارند همچنان باید توسط پرسنل مجاز نظارت شوند و قبل از اعطای مجوز باید یک بازرسی امنیتی و پلیس ملی را پشت سر بگذارند.
11_ظروف و بسته بندی آمونیوم نیترات
ظروف و بسته بندی نیترات آمونیوم باید از موادی ساخته شود که در برابر گرما، جرقه و ضربه مقاوم باشند. همچنین، این ظروف باید به گونه ای طراحی شوند که در برابر نفوذ آب و هوا محافظت کنند.
نیترات آمونیوم معمولاً به صورت گرانول یا مایع بسته بندی می شود. گرانول های نیترات آمونیوم معمولاً در کیسه های پلاستیکی یا فلزی بسته بندی می شوند. محلول های نیترات آمونیوم معمولاً در بشکه های فلزی یا پلاستیکی بسته بندی می شوند.
در هر صورت، ظروف و بسته بندی نیترات آمونیوم باید دارای برچسب هایی باشند که اطلاعات ایمنی مربوط به این ماده را ارائه دهند. این اطلاعات باید شامل موارد زیر باشد:
- نام ماده
- فرمول شیمیایی
- خطرات فیزیکی و شیمیایی
- اقدامات احتیاطی
- نحوه حمل و نقل و دفع
12_خطرات و موارد ایمنی آمونیوم نیترات
خطرات نیترات آمونیوم عبارتند از:
- انفجار: نیترات آمونیوم یک ماده منفجره است و می تواند در صورت تماس با گرما، جرقه یا ضربه منفجر شود. انفجار نیترات آمونیوم می تواند باعث آسیب جدی یا مرگ شود.
- تحریک پوست، چشم و دستگاه تنفسی: نیترات آمونیوم می تواند باعث تحریک پوست، چشم و دستگاه تنفسی شود. علائم تحریک پوست عبارتند از قرمزی، خارش و سوزش. علائم تحریک چشم عبارتند از قرمزی، سوزش و اشک ریزش. علائم تحریک دستگاه تنفسی عبارتند از سرفه، تنگی نفس و سوزش گلو.
- سمیت: نیترات آمونیوم در صورت بلعیده شدن می تواند سمی باشد. علائم مسمومیت با نیترات آمونیوم عبارتند از تهوع، استفراغ، اسهال، سردرد و تشنج.
موارد ایمنی در هنگام کار با نیترات آمونیوم
در هنگام کار با نیترات آمونیوم باید نکات ایمنی زیر را رعایت کرد:
- نیترات آمونیوم باید در مکانی خنک و خشک نگهداری شود.
- نیترات آمونیوم باید دور از گرما، جرقه و ضربه نگهداری شود.
- نیترات آمونیوم باید در ظروف در بسته نگهداری شود.
- در هنگام کار با نیترات آمونیوم باید از تجهیزات ایمنی مانند دستکش، عینک ایمنی و ماسک استفاده کرد.
علاوه بر این، نکات ایمنی زیر نیز باید رعایت شود:
- از تماس نیترات آمونیوم با پوست، چشم و دستگاه تنفسی خودداری کنید.
- در صورت تماس نیترات آمونیوم با پوست، چشم یا دستگاه تنفسی، بلافاصله ناحیه آسیب دیده را با آب فراوان بشویید.
- در صورت بلعیدن نیترات آمونیوم، بلافاصله به پزشک مراجعه کنید.

انفجار در بیروت
انفجار بیروت در تاریخ ۴ آگوست ۲۰۲۰ در بندر بیروت، پایتخت لبنان رخ داد. این انفجار یکی از قویترین انفجارهای غیرهستهای تاریخ بود و باعث کشته شدن بیش از ۲۰۰ نفر، زخمی شدن بیش از ۶۵۰۰ نفر و تخریب گسترده در شهر شد.
علت اصلی انفجار، آتشسوزی در یک انبار حاوی ۲۷۵۰ تن نیترات آمونیوم بود. نیترات آمونیوم یک ماده منفجره است که میتواند در صورت تماس با گرما، جرقه یا ضربه منفجر شود.
انفجار باعث ایجاد موج شوک شدیدی شد که ساختمانها و سازههای اطراف را ویران کرد. همچنین، باعث ایجاد ابر عظیمی از دود و گرد و غبار شد که باعث اختلال در تنفس و دید مردم شد.
انفجار بیروت خسارات مالی زیادی به لبنان وارد کرد. تخمین زده میشود که هزینه بازسازی مناطق آسیبدیده به بیش از ۱۵ میلیارد دلار برسد.
این انفجار تأثیرات سیاسی و اجتماعی زیادی نیز در لبنان داشت. اعتراضات گستردهای علیه دولت لبنان برگزار شد و دولت مجبور شد استعفا دهد.



13_بازار جهانی آمونیوم نیترات
بازار جهانی آمونیوم نیترات یک بازار بزرگ و در حال رشد است. این بازار توسط عوامل مختلفی از جمله افزایش جمعیت، رشد اقتصادی و افزایش تقاضا برای محصولات کشاورزی و مواد منفجره هدایت می شود.
حجم بازار جهانی آمونیوم نیترات
حجم بازار جهانی آمونیوم نیترات در سال 2022 حدود 200 میلیون تن تخمین زده می شود. این بازار انتظار می رود تا سال 2030 به حجم 270 میلیون تن برسد.
سهم کشورهای مختلف در بازار جهانی آمونیوم نیترات
چین بزرگترین تولید کننده و مصرف کننده آمونیوم نیترات در جهان است. این کشور در سال 2022 حدود 40 درصد از تولید جهانی آمونیوم نیترات را به خود اختصاص داد. سایر تولیدکنندگان عمده آمونیوم نیترات عبارتند از: ایالات متحده، روسیه، هند و اروپا.


