پتاسیم پرسولفات با فرمول شیمیایی K2S2O8 ترکیبی معدنی است. این ماده با نام دیگر آن یعنی پراکسی دی سولفات پتاسیم یا KPS نیز شناخته میشود. ازآنجاییکه خاصیت اکسیداسیون این ترکیب بسیار قوی است معمولاً به عنوان عامل سفیدکننده و اکسیدکننده به کار میرود. همچنین جهت آغازگر پلیمریزاسیون نیز از آن استفاده میشود.
خرید پتاسیم پرسولفات
برای خرید آنلاین پتاسیم پرسولفات با بهترین قیمت و تضمین کیفیت از بهترین برندهای موجود بازار از فروشگاه معتبر ایآز بازدید نمائید.
فهرست مطالب
پتاسیم پرسولفات اولین بار در سال 1874 توسط شیمیدان فرانسوی هنری موآسان کشف شد. او این ماده را با الکترولیز محلول سولفات پتاسیم در حضور اسید سولفوریک سنتز کرد.موآسان از یک سلول الکترولیتی با دو الکترود پلاتین استفاده کرد.
محلول سولفات پتاسیم را به عنوان الکترولیت استفاده کرد.از جریان الکتریکی مستقیم برای عبور از محلول استفاده کرد.در اثر الکترولیز، گاز اکسیژن در الکترود مثبت و گاز هیدروژن در الکترود منفی تولید شد.یونهای سولفات در محلول الکترولیت به یونهای پرسولفات تبدیل شدند.یونهای پرسولفات با یونهای پتاسیم ترکیب شدند و پتاسیم پرسولفات را تشکیل دادند.

در سال 1890، شیمیدان آلمانی ویلهلم اُستوالد روشی برای سنتز پتاسیم پرسولفات با استفاده از پراکسید هیدروژن و سولفات پتاسیم ابداع کرد.این روش جدید سنتز پتاسیم پرسولفات را ارزانتر و آسانتر کرد.
نامهای مختلف پتاسیم پرسولفات
نامهای رایج پتاسیم پرسولفات اسامی زیر هستند :
پتاسیم دیسولفوریک اسید
دیسولفات پتاسیم
نمک پتاسیم اسید پراکسیسولفوریک
نمک پتاسیم اسید پرسولفوریک
سولفات پتاسیم (VI)
تترااکسو سولفات پتاسیم (VI)
علاوه بر این نامها پتاسیم پرسولفات نامهای رایج دیگری نیز دارد.
نامهای مختلف پتاسیم پرسولفات به ساختار شیمیایی و خواص آن مربوط میشود.برخی از نامها رایجتر از نامهای دیگر هستند.در هنگام جستجوی اطلاعات در مورد پتاسیم پرسولفات، استفاده از نامهای مختلف میتواند مفید باشد.
ساختار پتاسیم پرسولفات
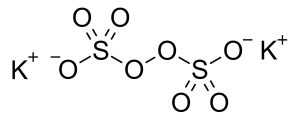
پتاسیم پرسولفات(Potassium Persulfate) با فرمول شیمیایی K2S2O8 یک نمک معدنی است که از دو یون پتاسیم (K+) و یک یون پرسولفات (S2O82-) تشکیل شده است.
یون پرسولفات متشکل از دو گروه سولفات (SO42-) است که توسط یک پیوند اکسیژن-اکسیژن به هم متصل شدهاند.این پیوند اکسیژن-اکسیژن کوتاه و قوی است و طول آن 1.44 Å است.زاویه بین دو گروه سولفات در یون پرسولفات 133.4 درجه است.
روش تولید پتاسیم پرسولفات
روشهای زیر برای تولید پتاسیم پرسولفات به کار برده می شوند :
#1 روش الکترولیز:این روش رایجترین روش تولید پتاسیم پرسولفات است.در این روش، محلول سرد بی سولفات پتاسیم (KHSO₄) در سولفوریک اسید (H₂SO₄) با جریان الکتریکی بالا الکترولیز میشود.
در این فرآیند، یونهای هیدروژن (H+) در کاتد و یونهای پرسولفات (S₂O₈²⁻) در آند تولید میشوند.یونهای پرسولفات با یونهای پتاسیم (K+) موجود در محلول ترکیب شده و پتاسیم پرسولفات (K₂S₂O₈) را تشکیل میدهند.
#2 اکسیداسیون الکتروشیمیایی:در این روش، از الکترولیز محلول سولفات پتاسیم (K₂SO₄) برای تولید پتاسیم پرسولفات استفاده میشود.
در این فرآیند، یونهای هیدروژن (H+) در کاتد و یونهای سولفات (SO₄²⁻) در آند تولید میشوند.یونهای سولفات در آند اکسید شده و به یونهای پرسولفات (S₂O₈²⁻) تبدیل میشوند.یونهای پرسولفات با یونهای پتاسیم (K+) موجود در محلول ترکیب شده و پتاسیم پرسولفات (K₂S₂O₈) را تشکیل میدهند.
خواص فیزیکی و شیمیایی پتاسیم پرسولفات
| خاصیت | مشخصه |
|---|---|
| نام | پتاسیم پرسولفات |
| فرمول شیمیایی | K₂S₂O₈ |
| جرم مولی | 270.32 g/mol |
| ظاهر | جامد بلوری سفید رنگ |
| بو | بدون بو |
| طعم | تلخ |
| حلالیت در آب | 50 g/L (20 °C) |
| نقطه ذوب | 100 °C (تخریب) |
| چگالی | 2.64 g/cm³ |
| pH | 1 (محلول 1%) |
پتاسیم پرسولفات در آب سرد حلالیت کمی دارد، اما در آب گرم حلالیت آن به طور قابل توجهی افزایش مییابد.
دلیل این امر این است که گرم شدن آب باعث افزایش انرژی جنبشی مولکولهای آب میشود و این امر به آنها اجازه میدهد تا یونهای پتاسیم پرسولفات را به طور موثرتری احاطه کرده و حل کنند.
نتیجه واکنش پتاسیم پرسولفات با اسیدها
نتیجه واکنش پتاسیم پرسولفات با اسیدها به نوع اسید و شرایط واکنش بستگی دارد.
در حالت کلی:پتاسیم پرسولفات با اسیدها واکنش میدهد و اسید پرسولفوریک و سولفات پتاسیم را تشکیل میدهد.معادله شیمیایی کلی این واکنش به شرح زیر است:
K2S2O8 + 2H+ → 2H2SO4 + 2K+
واکنش با اسید سولفوریک:پتاسیم پرسولفات با اسید سولفوریک واکنش میدهد و اسید پرسولفوریک و سولفات پتاسیم را تشکیل میدهد.معادله شیمیایی این واکنش به شرح زیر است:
K2S2O8 + H2SO4 → 2KHSO4 + H2SO5واکنش با اسید کلریدریک:پتاسیم پرسولفات با اسید کلریدریک واکنش میدهد و اسید پرسولفوریک، سولفات پتاسیم و کلر گاز را تشکیل میدهد.معادله شیمیایی این واکنش به شرح زیر است:
K2S2O8 + 2HCl → 2KHSO4 + Cl2 + H2Oکاربردهای پتاسیم پرسولفات
معمولا از پتاسیم پرسولفات به عنوان آغازگر واکنش های پلیمریزاسیون امولسیون در تهیه اکریلیک ها، پلی وینیل کلریدها، پلی استایرنها و نئوپرن استفاده میشود.مهمترین کاربردهای پتاسیم پرسولفات عبارتند از:
1.تصفیه آب:پتاسیم پرسولفات به عنوان یک عامل اکسید کننده برای از بین بردن آلاینده های آلی و معدنی از آب استفاده می شود.همچنین برای حذف آهن و منگنز از آب استفاده می شود.
2.سفید کردن منسوجات:همچنین از این ماده به عنوان یک عامل سفید کننده برای منسوجات استفاده می شود.پتاسیم پرسولفات لکه های رنگی را از روی پارچه ها و الیاف پاک می کند.
3.تولید مواد شیمیایی:پتاسیم پرسولفات در تولید مواد شیمیایی مختلف از جمله سولفات آمونیوم، سولفات پتاسیم و پراکسید هیدروژن استفاده می شود.
4.صنعت عکاسی: از این ترکیب در صنعت عکاسی برای فیکس کردن تصاویر استفاده می شود.پتاسیم پرسولفات نقره هالید را که در فیلم عکاسی استفاده می شود، به نقره فلزی تبدیل می کند.
5.تحلیل شیمیایی:پتاسیم پرسولفات در تجزیه و تحلیل شیمیایی برای تعیین غلظت مواد مختلف از جمله آهن، منگنز و سولفیت استفاده می شود.
کاربردهای دیگر:پتاسیم پرسولفات در صنعت کاغذسازی، صنعت چرم سازی و صنعت معدن استفاده می شود.
عوارض و خطرات پتاسیم پرسولفات
پتاسیم پرسولفات یک ماده شیمیایی خطرناک است که میتواند عوارض و خطرات مختلفی برای سلامتی انسان ایجاد کند.
- تحریک پوست: تماس با پتاسیم پرسولفات میتواند باعث تحریک پوست، قرمزی، خارش و سوزش شود.
- تحریک چشم: از دیگر خطرات پتاسیم پرسولفات ، تماس با آن میتواند باعث تحریک چشم، قرمزی، سوزش، اشک ریزش و تاری دید شود.
- تحریک سیستم تنفسی: استنشاق پتاسیم پرسولفات میتواند باعث تحریک سیستم تنفسی، سرفه، عطسه، تنگی نفس و درد قفسه سینه شود.
- سمیت: بدانید که بلع پتاسیم پرسولفات میتواند سمی باشد و باعث تهوع، استفراغ، اسهال، درد شکم و سرگیجه شود.
خطرات:
- آتشسوزی: پتاسیم پرسولفات در مجاورت مواد آلی قابل اشتعال میتواند آتشسوزی ایجاد کند.
- انفجار: پتاسیم پرسولفات در مجاورت مواد قلیایی قوی میتواند منفجر شود.

پس بنابراین سعی کنید
- هنگام کار با پتاسیم پرسولفات، از عینک، دستکش و لباس محافظ استفاده کنید.
- در محلی با تهویه مناسب کار کنید..
- در صورت تماس با پتاسیم پرسولفات، محل را با آب فراوان بشویید.
- در صورت آتش سوزی، از آب یا پودر شیمیایی خشک برای خاموش کردن کمک بگیرید.
شرایط نگهداری و ذخیره سازی پتاسیم پرسولفات
شرایط نگهداری:
- محل نگهداری: پتاسیم پرسولفات را باید در محلی خشک، خنک و دور از نور مستقیم خورشید نگهداری کرد.
- ظرف نگهداری: این ماده را باید در ظرفی دربسته و از جنس پلاستیک یا فلز ضد زنگ نگهداری کرد.
- شرایط دما: پتاسیم پرسولفات را باید در دمای زیر 30 درجه سانتیگراد نگهداری کرد.



شرایط ذخیره سازی:
- مقادیر کم: مقادیر کم پتاسیم پرسولفات را میتوان در قفسههای مواد شیمیایی در آزمایشگاه نگهداری کرد.
- مقادیر زیاد: مقادیر زیاد پتاسیم پرسولفات را باید در انبار مواد شیمیایی خطرناک نگهداری کرد.
نکات مهم:
- پتاسیم پرسولفات را باید دور از مواد قابل اشتعال و مواد قلیایی قوی نگهداری کرد.
- نباید پتاسیم پرسولفات را با مواد دیگر مخلوط کرد.
بازار جهانی پتاسیم پرسولفات
ارزش بازار جهانی پتاسیم پرسولفات در سال 2022 برابر با 4742 میلیون دلار بوده است.پیشبینی میشود این بازار تا سال 2029 با رشد 4.8 درصدی به 6566.6 میلیون دلار برسد.
آسیا و اقیانوسیه بزرگترین بازار پتاسیم پرسولفات در جهان را دارند.چین، هند و ژاپن از بزرگترین مصرف کنندگان پتاسیم پرسولفات هستند.رقابت شدید بین تولیدکنندگان این ماده وجود دارد.نوسانات قیمت مواد اولیه بر قیمت پتاسیم پرسولفات تاثیرگذار است.