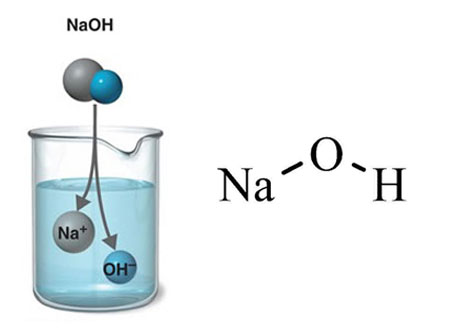
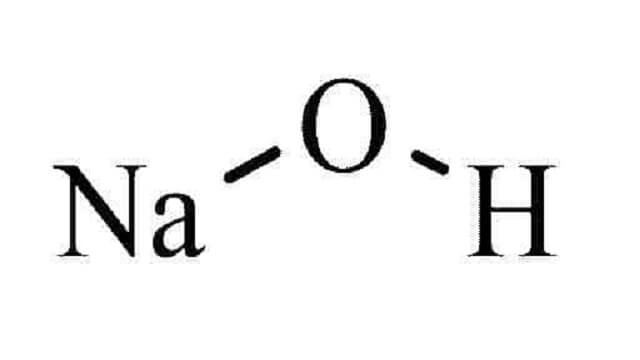سدیم هیدروکسید، با فرمول شیمیایی NaOH، یک ترکیب شیمیایی قلیایی سفید جامد با خاصیت خورندگی است. این ماده به عنوان سود سوزآور، سودای کاستیک، یا هیدروکسید سدیم نیز شناخته می شود. سدیم هیدروکسید در آب به شدت حل می شود و محلول آن قلیایی است.
سدیم هیدروکسید یکی از پرکاربردترین مواد شیمیایی در جهان است. از این ماده در صنایع مختلف از جمله کاغذسازی، نساجی، پتروشیمی، تولید مواد شوینده، تصفیه آب و فاضلاب، و ساخت مواد آرایشی استفاده می شود.
خرید سدیم هیدروکسید
برای خرید آنلاین سدیم هیدروکسید با بهترین قیمت و تضمین کیفیت از بهترین برندهای موجود بازار از فروشگاه معتبر ایآز بازدید نمائید
تاریخچه سدیم هیدروکسید
تاریخچه تولید سدیم هیدروکسید به قرن ها قبل برمی گردد. اولین اشاره به این ماده در کتاب “المخترع فی فنون من الصنع” نوشته محمد زکریای رازی، دانشمند ایرانی قرن یازدهم میلادی، یافت شده است. رازی روشی برای تولید سدیم هیدروکسید از خاکستر گیاهان حاوی سدیم مانند علف شور ابداع کرد.
در قرن هفدهم میلادی، صابون سازان اروپایی از سدیم هیدروکسید برای تولید صابون استفاده می کردند. آنها این ماده را با جوشاندن خاکستر گیاهان حاوی سدیم با آب تولید می کردند.
در قرن نوزدهم میلادی، فرآیندهای صنعتی برای تولید سدیم هیدروکسید توسعه یافت. در سال 1888، روش الکترولیز نمک خوراکی برای تولید سدیم هیدروکسید ابداع شد. این روش امروزه متداول ترین روش تولید سدیم هیدروکسید است.
فهرست مطالب
خواص فیزیکی و شیمیایی و ویژگی سدیم هیدروکسید
سدیم هیدروکسید یک ماده جامد سفید کریستالی با چگالی 2.13 گرم بر سانتی متر مکعب است. این ماده در آب به شدت حل می شود و محلول آن قلیایی است. محلول سدیم هیدروکسید با اسید واکنش می دهد و آب و نمک تولید می کند.
مقایسه سدیم هیدروکسید با هیدروکسید پتاسیم
هیدروکسید پتاسیم (KOH) دارای کاتیون پتاسیم و سدیم هیدروکسید (NaOH) دارای کاتیون سدیم می باشد. هر دو ترکیب باز بسیار قوی هستند و هنگام واکنش با آب گرما تولید می کنند. حال آن که سدیم هیدروکسید گرمازایی بیشتری نسبت به هیدروکسید پتاسیم دارد، بدین شرح که گرمای بیشتری در واکنش بین سدیم هیدروکسید و آب در مقایسه با KOH و آب آزاد می شود. همچنین قابل ذکر است که سدیم هیدروکسید درشت مولکول تر بوده و رسانایی اش بیشتر از هیدروکسید پتاسیم می باشد. قدرت تفکیک یونی NaOH بیشتر از KOH بوده و به سرعت در آب به یون های تشکیل دهنده خود تفکیک می شود.
سدیم هیدروکسید جامد و مایع
سود سوزآور یا سدیم هیدروکسید در دو نوع زیر تولید می گردد:
- سود مایع
- سود جامد (پرک یا کاستیک)
- 1.هیدروکسید سدیم جامد معمولاً به صورت پرک یا دانه ای عرضه می شود. پرک هیدروکسید سدیم ماده ای سفید و کریستالی است که به راحتی در آب حل می شود. دانه های هیدروکسید سدیم نیز سفید و کریستالی هستند، اما اندازه آنها بزرگتر از پرک ها است.
- 2.هیدروکسید سدیم مایع معمولاً در غلظت های 30٪ یا 50٪ عرضه می شود. هیدروکسید سدیم مایع یک مایع بی رنگ با بوی تند است. این مایع بسیار خورنده است و باید با احتیاط استفاده شود.
2روش تولید سدیم هیدروکسید
تولید هیدروکسید سدیم به دو روش انجام می شود:
روش الکترولیز
این روش متداول ترین روش تولید هیدروکسید سدیم است. در این روش، محلول اشباع شده سدیم کلرید (NaCl) را در یک سلول الکترولیز قرار می دهند. جریان الکتریکی از طریق محلول عبور می کند و باعث می شود که سدیم کلرید به سدیم هیدروکسید و کلر تجزیه شود.
معادله واکنش الکترولیز سدیم کلرید به شرح زیر است:
2NaCl → 2Na + Cl2
2Na + 2H2O → 2NaOH + H2
در این روش، سدیم هیدروکسید در کاتد تولید می شود. کاتد یک صفحه فلزی است که در انتهای منفی سلول الکترولیز قرار دارد. کلر نیز در آند تولید می شود. آند یک صفحه فلزی است که در انتهای مثبت سلول الکترولیز قرار دارد.
روش سوزاندن سدیم کربنات
در این روش، سدیم کربنات (Na2CO3) را در دمای بالا می سوزانند. در این فرآیند، سدیم کربنات به سدیم اکسید (Na2O) و دی اکسید کربن (CO2) تجزیه می شود. سپس، سدیم اکسید را با آب واکنش می دهند تا سدیم هیدروکسید تولید شود.
معادله واکنش سوزاندن سدیم کربنات به شرح زیر است:
2Na2CO3 → Na2O + CO2
Na2O + H2O → 2NaOH
در این روش، سدیم هیدروکسید در محلول آبی تولید می شود.
مراحل تولید هیدروکسید سدیم به روش الکترولیز
مراحل تولید هیدروکسید سدیم به روش الکترولیز به شرح زیر است:
- آماده سازی محلول سدیم کلرید
ابتدا، محلول اشباع شده سدیم کلرید (NaCl) تهیه می شود. این کار با حل کردن سدیم کلرید در آب انجام می شود. غلظت محلول سدیم کلرید باید به گونه ای باشد که هدایت الکتریکی آن کافی باشد.
- الکترولیز محلول سدیم کلرید
سپس، محلول سدیم کلرید را در یک سلول الکترولیز قرار می دهند. جریان الکتریکی از طریق محلول عبور می کند و باعث می شود که سدیم کلرید به سدیم هیدروکسید و کلر تجزیه شود.
- جداسازی سدیم هیدروکسید از محلول
سدیم هیدروکسید تولید شده در محلول آبی است. این محلول را می توان با روش های مختلف از جمله تبخیر، اسمز معکوس، و الکترودیالیز جداسازی کرد.
مراحل تولید هیدروکسید سدیم به روش سوزاندن سدیم کربنات
مراحل تولید هیدروکسید سدیم به روش سوزاندن سدیم کربنات به شرح زیر است:
- آماده سازی سدیم کربنات
ابتدا، سدیم کربنات تهیه می شود. این کار با واکنش سدیم هیدروکسید با دی اکسید کربن انجام می شود.
- سوزاندن سدیم کربنات
سدیم کربنات را در دمای بالا می سوزانند. در این فرآیند، سدیم کربنات به سدیم اکسید و دی اکسید کربن تجزیه می شود.
- تولید سدیم هیدروکسید از سدیم اکسید
سدیم اکسید را با آب واکنش می دهند تا سدیم هیدروکسید تولید شود.
کاربردهای هیدروکسید سدیم








سدیم هیدروکسید در صنایع مختلف کاربردهای فراوانی دارد. از جمله کاربردهای این ماده می توان به موارد زیر اشاره کرد:
- کاغذسازی: سدیم هیدروکسید در تولید خمیر کاغذ استفاده می شود. این ماده با تجزیه الیاف چوبی به سلولز، باعث می شود که خمیر کاغذ نرم و قابل شکل دهی شود.
- نساجی: سدیم هیدروکسید در رنگرزی و تکمیل پارچه استفاده می شود. این ماده با از بین بردن چربی و سایر ناخالصی ها از سطح پارچه، باعث می شود که رنگ بهتر به پارچه بچسبد.
- پتروشیمی: سدیم هیدروکسید در تولید پلاستیک، الیاف مصنوعی، و سایر محصولات پتروشیمی استفاده می شود.
- تولید مواد شوینده: سدیم هیدروکسید در تولید مواد شوینده مانند پودر لباسشویی، مایع ظرفشویی، و صابون استفاده می شود. این ماده به عنوان یک عامل پاک کننده و سفید کننده عمل می کند.
- تصفیه آب و فاضلاب: سدیم هیدروکسید در تصفیه آب و فاضلاب استفاده می شود. این ماده با از بین بردن آلاینده ها مانند روغن، چربی، و مواد آلی، باعث بهبود کیفیت آب می شود.
- ساخت مواد آرایشی: سدیم هیدروکسید در ساخت مواد آرایشی مانند کرم، ژل، و مایع پاک کننده استفاده می شود. این ماده به عنوان یک عامل تثبیت کننده و سفید کننده عمل می کند.

سدیم هیدروکسید به دلیل توانایی آن در حل شدن از طریق چربی،یک پاک کننده شیشه درخشان است
یکی دیگر از کاربردهای سود جهت از بین بردن تلخی زیتون و جداسازی روغن است.
زیتونهای تازه حاوی ترکیبات گوگردی هستند که باعث ایجاد تلخی در روغن زیتون میشوند. برای از بین بردن این تلخی، از فرآیندی به نام “هیدرولیز” استفاده میشود. در این فرآیند، زیتونهای تازه را با محلول سدیم هیدروکسید (NaOH) مخلوط میکنند. سدیم هیدروکسید با ترکیبات گوگردی واکنش میدهد و آنها را از بین میبرد.
گرفتن تلخی زیتون با سدیم هیدروکسید
مراحل گرفتن تلخی زیتون با سدیم هیدروکسید
- زیتونها را به خوبی بشویید و پوست آنها را بگیرید.
- زیتونهای پوست کنده را به قطعات کوچک خرد کنید.
- محلول سدیم هیدروکسید را آماده کنید. غلظت محلول سدیم هیدروکسید باید 2 درصد باشد. برای تهیه محلول 2 درصد، 2 گرم سدیم هیدروکسید را در 100 میلی لیتر آب حل کنید.
- زیتونهای خرد شده را در محلول سدیم هیدروکسید بریزید.
- مخلوط را به مدت 10 تا 15 دقیقه در دمای 60 درجه سانتیگراد هم بزنید.
- مخلوط را از صافی رد کنید.
- روغن زیتون را از تفاله زیتون جدا کنید.روغن گیری با سدیم هیدروکسید

روغن گیری با سدیم هیدروکسید
علاوه بر گرفتن تلخی زیتون، از سدیم هیدروکسید برای روغن گیری از زیتون نیز استفاده میشود. این روش روغن گیری به روش “هیدرولیز” معروف است.
مراحل روغن گیری با سدیم هیدروکسید
- زیتونها را به خوبی بشویید و پوست آنها را بگیرید.
- زیتونهای پوست کنده را به قطعات کوچک خرد کنید.
- محلول سدیم هیدروکسید را آماده کنید. غلظت محلول سدیم هیدروکسید باید 2 درصد باشد. برای تهیه محلول 2 درصد، 2 گرم سدیم هیدروکسید را در 100 میلی لیتر آب حل کنید.
- زیتونهای خرد شده را در محلول سدیم هیدروکسید بریزید.
- مخلوط را به مدت 10 تا 15 دقیقه در دمای 60 درجه سانتیگراد هم بزنید.
- مخلوط را از صافی رد کنید.
- روغن زیتون را از تفاله زیتون جدا کنید.
- روغن زیتون را سانتریفیوژ کنید تا آب و ناخالصیها از آن جدا شوند.
- روغن زیتون را در بطریهای شیشهای دربسته نگهداری کنید.
مزایا و معایب روغن گیری با سدیم هیدروکسید
مزایا:
- این روش روغن گیری نسبت به روشهای سنتی روغن گیری سریعتر و آسانتر است.
- روغن زیتون حاصل از این روش روغن گیری غلیظتر و خوشطعمتر است.
معایب:
- این روش روغن گیری باعث کاهش مقدار روغن زیتون حاصل میشود.
- روغن زیتون حاصل از این روش روغن گیری باید بیشتر از روشهای سنتی روغن گیری فیلتر شود تا آب و ناخالصیها از آن جدا شوند.
نتیجه گیری
گرفتن تلخی زیتون و روغن گیری با سدیم هیدروکسید روشهای نسبتاً سادهای هستند که میتوان در خانه نیز از آنها استفاده کرد. با این حال، هنگام کار با سدیم هیدروکسید باید نکات ایمنی را به دقت رعایت کرد.
هدف استفاده ازسدیم هیدروکسید در پالایش نفت

از هیدروکسید سدیم در پالایش نفت برای اهداف مختلفی استفاده می شود، از جمله:
- از بین بردن اسیدهای آلی
هیدروکسید سدیم یک باز قوی است و می تواند اسیدهای آلی را خنثی کند. این امر برای حذف اسیدهای آلی از نفت خام ضروری است، زیرا این اسیدها می توانند باعث خوردگی تجهیزات پالایشگاهی شوند.
- جداسازی سولفورهای آلی
هیدروکسید سدیم می تواند با سولفورهای آلی واکنش دهد و نمک های سدیم غیرفرار تولید کند. این نمک ها را می توان از نفت خام جدا کرد و به عنوان محصول جانبی استفاده کرد.
- تولید بنزین
هیدروکسید سدیم می تواند برای تبدیل ترکیبات نفتی سنگین به ترکیبات نفتی سبک تر استفاده شود. این امر به بهبود کیفیت بنزین و سایر محصولات پالایشگاهی کمک می کند.
- تولید اسیدهای معدنی
هیدروکسید سدیم را می توان برای تولید اسیدهای معدنی مانند اسید کلریدریک و اسید سولفوریک استفاده کرد. این اسیدها در صنایع مختلف کاربرد دارند.
برخی از کاربردهای خاص هیدروکسید سدیم در پالایش نفت عبارتند از:
- در واحد تقطیر نفت خام، از هیدروکسید سدیم برای خنثی کردن اسیدهای آلی استفاده می شود که در طول فرآیند تقطیر تولید می شوند.
- در واحد تبدیل کاتالیستی، از هیدروکسید سدیم برای تبدیل ترکیبات نفتی سنگین به ترکیبات نفتی سبک تر استفاده می شود.
- در واحد تصفیه، از هیدروکسید سدیم برای از بین بردن اسیدهای آلی و سولفورهای آلی از نفت خام استفاده می شود.
- در واحد هیدروژن زدایی، از هیدروکسید سدیم برای تولید اسیدهای معدنی مانند اسید کلریدریک و اسید سولفوریک استفاده می شود.
هیدروکسید سدیم یک ماده ضروری در پالایش نفت است و برای بهبود کیفیت محصولات پالایشگاهی و افزایش بهره وری پالایشگاه ها ضروری است.
نگهداری و بسته بندی صحیح سدیم هیدروکسید
جابجایی : قبل از جابجایی، مهم است که تمام کنترل های مهندسی در حال اجرا باشند و الزامات تجهیزات حفاظتی و اقدامات بهداشت فردی رعایت شود. فقط پرسنل آموزش دیده باید با این محصول کار کنند. فورا نشت، ریزش یا خرابی تجهیزات ایمنی (مانند سیستم تهویه) را گزارش دهید. از تولید بخار یا مه خودداری کنید. از ایجاد گرد و غبار خودداری کنید. از ابزارها و تجهیزات مقاوم در برابر خوردگی استفاده کنید.
هرگز به مواد خورنده آب اضافه نکنید. همیشه مواد خورنده را به آرامی به آب سرد اضافه کنید.
هرگز از ظروف خالی استفاده مجدد نکنید، حتی اگر به نظر تمیز می رسند.
ظروف را در صورت عدم استفاده یا خالی محکم بسته نگه دارید.
ذخیره سازی : در محلی، خنک، خشک، دارای تهویه مناسب، جدا از مواد ناسازگار نگهداری شود. مقدار را در انبار به حداقل برسانید.
در ظروف، دارای برچسب، نگهداری شود.
از درام های هواکش برای جلوگیری از افزایش فشار استفاده کنید.
ظروف خالی ممکن است حاوی بقایای خطرناک باشند. جداگانه ذخیره کنید. بسته نگه دارید.
با نگهداری ظروف در سینی های ساخته شده از مواد سازگار، نشت یا نشت را مهار کنید.
بازار جهانی سدیم هیدروکسید
بازار جهانی سدیم هیدروکسید یک بازار بزرگ و رو به رشد است. این بازار در سال 2022 ارزشی معادل 20.5 میلیارد دلار داشت و پیش بینی می شود که تا سال 2028 به ارزش 27.4 میلیارد دلار برسد.
عوامل محرک رشد بازار سدیم هیدروکسید
عوامل مختلفی بر رشد بازار سدیم هیدروکسید تأثیر می گذارند، از جمله:
- رشد جمعیت و افزایش تقاضا برای مواد غذایی و محصولات بهداشتی
- توسعه صنایع جدید مانند تولید باتری های لیتیوم یونی
- افزایش استفاده از سدیم هیدروکسید در فرآیندهای تصفیه آب و فاضلاب
بخش های اصلی بازار سدیم هیدروکسید
بازار سدیم هیدروکسید را می توان به دو بخش اصلی تقسیم کرد:
- بخش صنعتی: این بخش شامل کاربردهای سدیم هیدروکسید در صنایع مختلف مانند کاغذسازی، نساجی، پتروشیمی، و تولید مواد شوینده است.
- بخش مصرفی: این بخش شامل کاربردهای سدیم هیدروکسید در محصولات مصرفی مانند پاک کننده های خانگی، صابون و شامپو است.
کشورهای پیشرو در تولید و مصرف سدیم هیدروکسید
چین، ایالات متحده، و ژاپن بزرگترین تولیدکنندگان سدیم هیدروکسید در جهان هستند. این سه کشور همچنین بزرگترین مصرف کنندگان سدیم هیدروکسید در جهان هستند.
خطرات، MSDS و نکات ایمنی:
به گفته مرکز کنترل و پیشگیری از بیماری های ایالات متحده برای ثبت مواد سمی و ثبت بیماری، قرار گرفتن در معرض هیدروکسید سدیم به شکل جامد یا محلول آن می تواند باعث تحریک پوست و چشم شود. کارگران در تأسیساتی که در آن ها هیدروکسید سدیم تولید یا استفاده می شود باید دستورالعمل های ایمنی محصول را رعایت کنند.
اداره ایمنی و بهداشت شغلی ایالات متحده (OSHA) دستورالعمل ها و محدودیت های مجاز قرار گرفتن در معرض را برای کارگران در صنایع و تأسیساتی که در آن مواد هیدروکسید سدیم استفاده می شود، در وب سایت OSHA تعیین کرده است.
مؤسسه ملی ایمنی و بهداشت شغلی اطلاعات عمومی ایمنی را در مورد حمل و نقل هیدروکسید سدیم، از جمله راهنمایی در مورد بسته بندی و ذخیره سازی، ریختن، دفع، و بسته بندی و برچسب گذاری را برای کارگران ارائه می دهد.
سازمان غذا و دارو (FDA) استفاده از هیدروکسید سدیم به عنوان یک افزودنی غذایی در سطوح کمتر از 1 درصد را مجاز اعلام کرده است.

همانطور که گفته شد سدیم هیدروکسید یک ماده خورنده است و می تواند باعث سوختگی پوست، چشم، و دستگاه گوارش شود. همچنین می تواند باعث تحریک دستگاه تنفسی شود.
علائم سوختگی سدیم هیدروکسید
- سوختگی پوست: سوختگی سدیم هیدروکسید معمولاً به صورت تاول های سفید یا زرد ظاهر می شود. این سوختگی ها می توانند بسیار دردناک باشند و ممکن است هفته ها طول بکشد تا بهبود یابند.
- سوختگی چشم: سوختگی چشم ناشی از سدیم هیدروکسید می تواند باعث قرمزی، تورم، سوزش، و تاری دید شود. در موارد شدید، ممکن است باعث آسیب دائمی به چشم شود.
- سوختگی دستگاه گوارش: سوختگی دستگاه گوارش ناشی از سدیم هیدروکسید می تواند باعث درد شکم، حالت تهوع، استفراغ، و اسهال شود. در موارد شدید، ممکن است باعث سوراخ شدن روده شود.
- تحریک دستگاه تنفسی: استنشاق بخارات سدیم هیدروکسید می تواند باعث تحریک دستگاه تنفسی شود. علائم تحریک دستگاه تنفسی عبارتند از سرفه، تنگی نفس، و گلودرد.
نکات ایمنی سدیم هیدروکسید
برای کاهش خطرات ناشی از سدیم هیدروکسید، باید اقدامات ایمنی زیر را انجام داد:
- همیشه از تجهیزات ایمنی مناسب مانند دستکش، عینک ایمنی، و لباس کار هنگام کار با سدیم هیدروکسید استفاده کنید.
- سدیم هیدروکسید را در محلی خنک و خشک و دور از دسترس کودکان و حیوانات خانگی نگهداری کنید.
- هرگز سدیم هیدروکسید را با اسید مخلوط نکنید. این واکنش می تواند باعث تولید گازهای سمی شود.
- در صورت تماس سدیم هیدروکسید با پوست، چشم، یا دستگاه گوارش، بلافاصله ناحیه آسیب دیده را با آب فراوان بشویید. در صورت تماس سدیم هیدروکسید با چشم، پلک ها را به مدت 15 دقیقه با آب باز نگه دارید.
کمک های اولیه برای سوختگی سدیم هیدروکسید
در صورت تماس سدیم هیدروکسید با پوست، چشم، یا دستگاه گوارش، بلافاصله اقدامات زیر را انجام دهید:
- در صورت تماس سدیم هیدروکسید با پوست، ناحیه آسیب دیده را با آب فراوان بشویید. این کار را به مدت حداقل 15 دقیقه ادامه دهید.
- در صورت تماس سدیم هیدروکسید با چشم، پلک ها را به مدت 15 دقیقه با آب باز نگه دارید.
- در صورت بلعیدن سدیم هیدروکسید، فوراً با پزشک تماس بگیرید.
با رعایت نکات ایمنی، می توان از خطرات ناشی از سدیم هیدروکسید جلوگیری کرد.